Понятие нуклеофильности
Нуклеофильность характеризует реакционную способность нуклеофила, показывает количественную меру его силы в данной химической реакции. Под нуклеофильностью понимают характер влияния на скорость реакции нуклеофильного замещения основания Льюиса.
Нуклеофильность является кинетической характеристикой основания по отношению к электрофильному центру, у которого происходит нуклеофильное замещение ($sp3$-гибридизованный углеродный атом в $RZ$, $sp2$-гибридизованный углеродный атом в $R-C(O)-Z$ и т.д.).
В зависимости от электрофильного центра ($sp3$-, $sp2$-гибридный атом углерода и др.) относительная нуклеофильность разных нуклеофильных реагентов будет меняться.
Например: У атома серы в $RS^{δ+} - Z^{δ-}$; при обмене лигандов у платины в комплексах платины (II).
Абсолютную шкалу нуклеофильности в реакциях замещения для разных электрофильных центров составить нельзя. Хорошими нуклеофилами могут быть как сильные, так и слабые основания.
Нуклеофильность в реакциях нуклеофильного замещения $SN1$ и $SN2$ не идентична.
Например: Скорость реакции $SN2$ связана со способностью нуклеофила замещать уходящую группу в процессе прямого замещения. Или в случае $SN1$-реакции нуклеофильность реагента влияет на соотношение продуктов реакции, но не влияет на скорость ионизации субстрата. По отношению к нуклеофильным реагентам различной природы карбокатион обладает различной избирательностью.
Факторы, определяющие нуклеофильность реагента для SN-реакций
К основным факторам, определяющим нуклеофильность в реакциях $SN2$-типа, относят:
- основность;
- поляризуемость;
- энергию сольватации основания Льюиса;
- электроотрицательность атакующего атома;
- силу связи основания Льюиса с $2р$-орбиталью углерода;
- эффективный объем нуклеофила.
Поляризуемость нуклеофильного агента зависит от способности его электронной оболочки деформироваться под действием внешнего электромагнитного поля.
В пределах одной группы периодической системы Д.Менделеева поляризуемость возрастает сверху вниз.
Изменение поляризуемости в разных группах (VII, VI, V группы соответственно) указывает на деформируемость внешней электронной оболочки, удаленной от ядра.
$I^− > Br^− > Cl^− > F^−;$
$RSe^− > RS^− > RO^−;$
$R_3As~R_3P > R_3N.$
Чем больше электроотрицательность нуклеофила, тем прочнее он удерживает свою электронную пару.
Неподеленная электронная пара нуклеофила в реакциях $SN2$-типа взаимодействует с разрыхляющей орбиталью связи $C-Z$, поэтому его высокая электроотрицательность нежелательна при замещении по $SN2$-механизму. Высокая энергия сольватации снижает энергию основного состояния нуклеофила относительно переходного состояния, что ведет к снижению скорости реакции.
Десольватация нуклеофила приведет к уменьшению энергии активации, что способствует увеличению скорости замещения $SN2$-реакции. Более прочная связь, в образовании которой принимали участие нуклеофил и углеродный атом в $R-Z$ в переходном состоянии, снижает энергию активации и способствует увеличению скорости реакции.
Нуклеофилы больших объемов должны быть менее реакционноспособными, чем маленькие нуклеофилы из-за пространственных препятствий, которые возникают в бипирамидальном переходном состоянии $SN2$-реакции.
Методы определения нуклеофильности
Нуклеофильность можно определить по относительным скоростям реакции стандартного субстрата с различными нуклеофильными реагентами.
Свеном и Скоттом введены специальные константы нуклеофильности n для стандартного субстрата метилйодида с разными нуклеофилами в метаноле (для метанола $n =0,0$). Тогда:
$n_{CH_3 I}=log(\frac{k_Nu}{k_{CH_3 OH}})$ в $CH_3 OH$ при $25^0 C.$
В протонной среде нуклеофильность различных реагентов не взаимосвязана с их основностью по отношению к протону. У бромид-, азид-, феноксид-ионов одинаковая нуклеофильность по отношению к метилйодиду в метаноле, но по основности они различаются более, чем на пятнадцать порядков. Те же отношения характерны и для йодид- и ацетат-анионов, $pKa$ сопряженных кислот различаются на 20 единиц.
Однако, у ацетат- и азид-ионов одинаковая основность, но для азид-иона константа нуклеофильности метилйодида намного больше, чем для ацетат-иона. Триэтиламин обладает более выраженными основными свойствами, чем триэтилфосфин, но триметилфосфин более сильный нуклеофил, чем его азотный аналог.
Если нуклеофилы имеют один донорный атом, то присутствует корреляция констант нуклеофильности и силы кислот. Например:
$CH_3 O^- > C_6 H_5 O^- > OAc^- > NO_3^-.$
В Периодической системе при движении по диагонали нуклеофильность уменьшается: $HO^- > F^-$ и $RS^- > Cl^-$, что можно объяснить изменением электроотрицательности. В нижней части Периодической системы расположена атомы большого размера с высокой поляризуемостью, поэтому при переходе сверху вниз в каждой группе нуклеофильность будет возрастать.
Нуклеофильность зависит от сольватации. При переходе от метанола к диполярным апротонным растворителям нуклеофильность галогенид-ионов имеет вид $F^- > Cl^- > Br^- > I^-.$
Энергии сольватации для меньших по размеру ионов с более концентрированным зарядом больше, чем для ионов большего размера, где заряд диффузен.
При нуклеофильной атаке на углеродный атом ион должен освободиться от части молекул растворителя, которые стабилизируют его в растворе. В противном случае ион не сможет приблизиться к атому углерода для образования связи.
Для ионов небольших размеров этот процесс менее выгоден. Поэтому ион хлора будет менее реакционноспособен, чем ион иода.
Для качественного предположения относительной нуклеофильности реагентов в реакциях $SN2$-типа применяют принцип ЖМКО (принцип жестких и мягких кислот и оснований). $sp3$-гибридизованный атом относится к мягким электрофильным центрам. Поэтому скорость $SN2$-реакции возрастает, если в качестве нклеофила используют мягкое основание Льюиса ($RS^-$, $R_3P$, $RSe^-$, $HOO^-$ и др.) и уменьшается для жестких оснований ($F^-$, $RNH_2$, $RCOO^-$, $RO^-$, $OH^-$, $NO_3^-$, $ClP_4^-$ и др.).
Согласно принципу ЖМКО в реакциях нуклеофильного замещения может наблюдаться симбиотический эффект: скорость реакции возрастает, если входящая и уходящая группы являются одновременно или мягкими, или жесткими основаниями Льюиса.
Симбиотический эффект в $SN2$-реакциях проявляется когда нуклеофильный реагент и уходящая группа относятся к мягким основаниям.
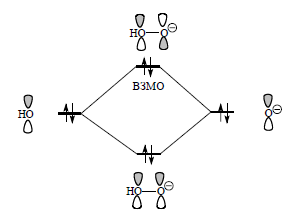
Альфа-эффект в нуклеофильном реагенте
Нейтральные молекулы или анионы, в состав которых входит атом с неподеленной электронной парой, непосредственно связанный с нуклеофильным центром, проявляют более сильные нуклеофильные свойства, чем их аналоги без подобного атома.
Повышенная нуклеофильность таких частиц называется α-эффектом.
Гидроксиламин, гидразин являются более сильными нуклеофилами, чем первичные амины и аммиак. Гипохлорид и пероксид-анион проявляют более сильные нуклеофильные свойства, чем гидроксид-ион.
Высокую нуклеофильность этих соединений нельзя объяснить с точки зрения их основности или поляризуемости. Реакционная способность этих нуклеофильных реагентов повышается в результате стабилизации переходного состояния нуклеофильной реакции электронами неподеленной пары соседнего атома:
В результате образуются две новые возмущенные молекулярные орбитали, одна с более низкой, а вторая, с более высокой энергией по сравнению с энергией неподеленных электронных пар изолированных друг от друга атомов.
Нетипично высокая энергия высшей занятой молекулярной орбитали приближает ее к низшей свободной молекулярной орбитали электрофила, что способствует протеканию $SN2$-реакции.