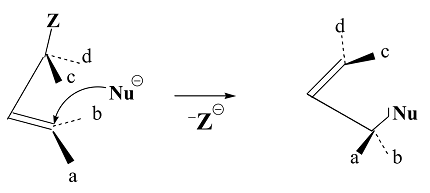
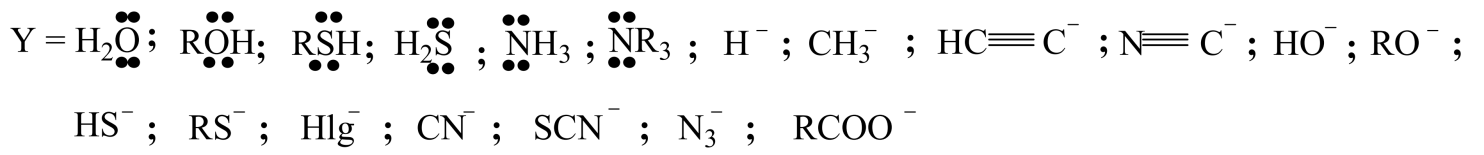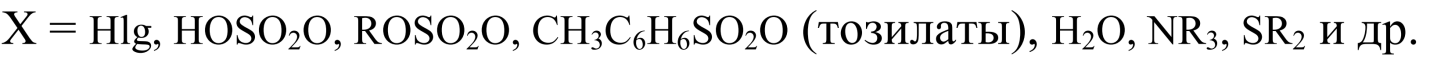Общую схому реакций нуклеофильного замещения можно представить следующим уравнением:

В качестве нуклеофильных агентова $Y$ могут выступать как анионы, так и нейтральные молекулы, обладающиея хотя бы одной неподеленной парой электронов, то есть основания Льюиса:
Группы $X$ называются «уходящими группами». Они обладают высокой электроотрицательностью и могут уходить как в виде анионов, так и в виде незаряженных молекулы:
В большинстве случаев реакция нуклеофильного замещения сопровождается конкурирующей с ней реакцией отщепления, так как нуклеофильные реагенты могут взаимодействовать не только с положительным атомом углерода, но и с атомом водорода, находящимся в $α$-положении, отщепляя его в виде протона. Кроме того реакция нуклеофильного замещения может сопровождатся перегруппировкой.
Реакция нуклеофильного замещения ($SN$) при атоме $C$ с $sp3$ гибридизацией может осуществляться как диссоциативный (мономолекулярный $SN1$) или как синхронный (бимолекулярный $SN2$) процессы. Но когда процесс нуклеофильного замещения идет по иным закономерностям, не соответствующим $SN1$, $SN2$ механизмам то говорят также о механизме $SNi$ и $SN’.$
Нуклеофильный механизм замещения SNi
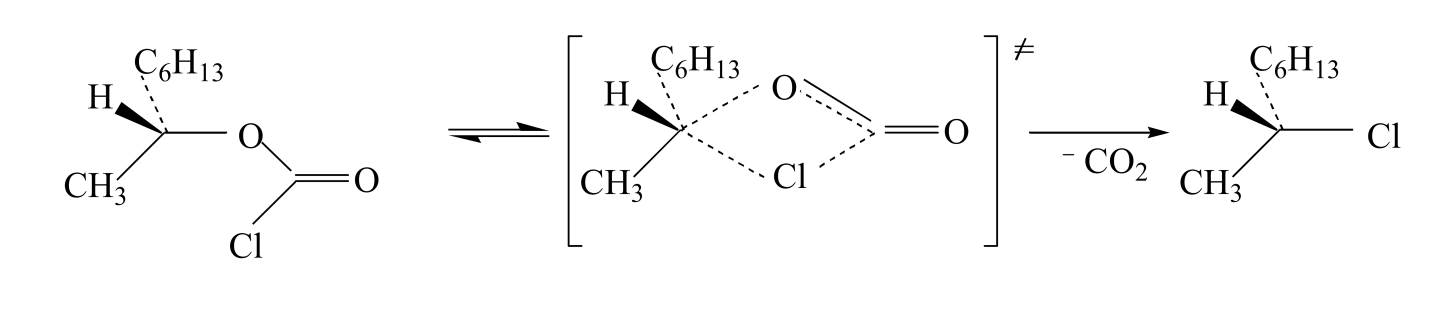
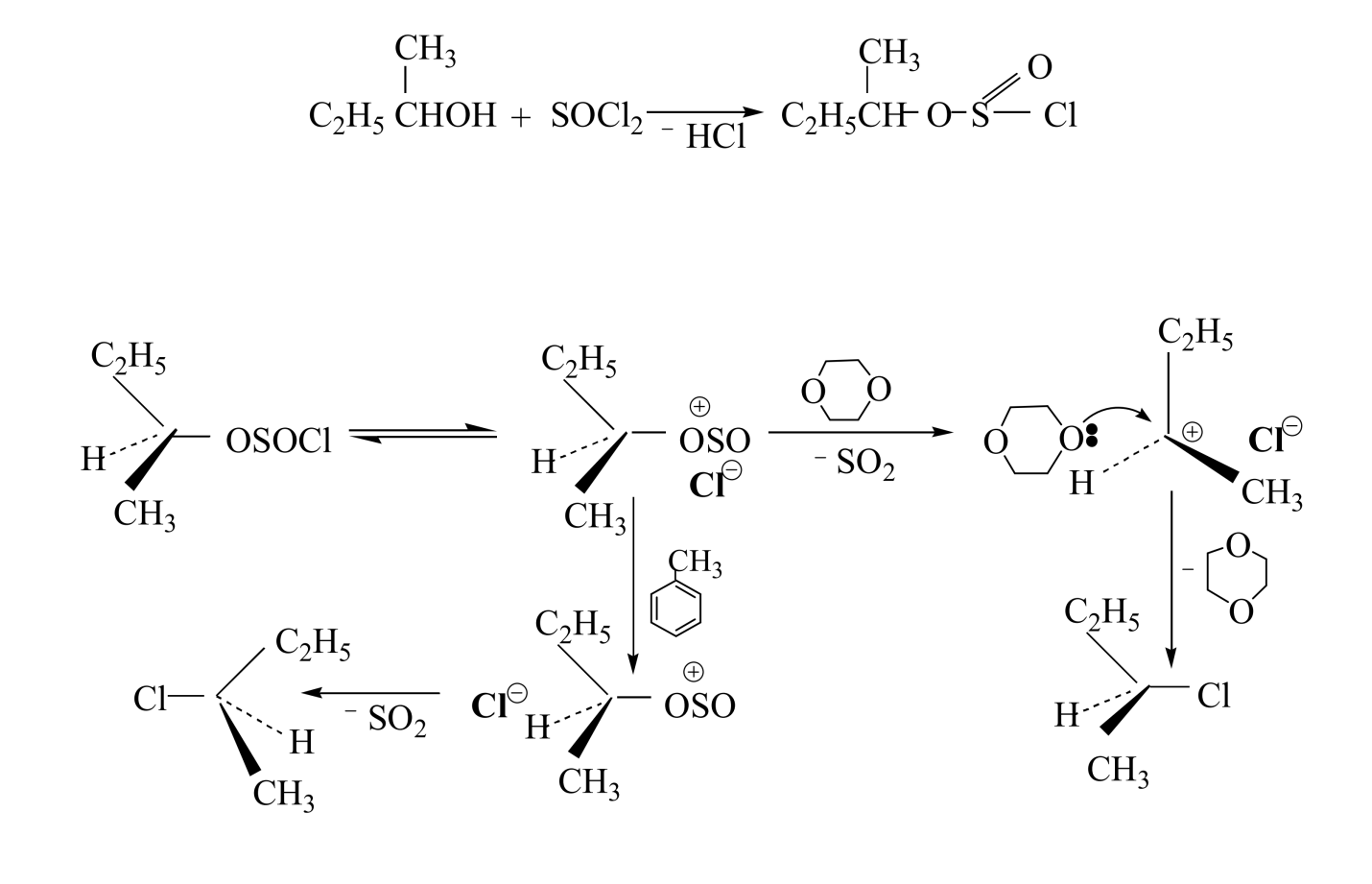
Механизм $SNi$ часто условно называют механизмом внутреннего нуклеофильного замещения, и он является специальным случаем $SN1$ - механизма, в котором уходящая группа имеет сложное строение. В результате нуклеофильного замещения $SNi$ часто происходит полное сохранение конфигурации вещества. Например, при разложении вторичных алкилхлорформиатов наблюдается сохранение конфигурации. Ингольд и Хьюз предположили, что разложение протекает через циклическое четырехцентровое переходное состояние:
Однако разложение алкилхлорсульфитов протекает не через циклическое четырехцентровое переходное состояние. Причем, замечено, что тип растврителя влияет на конфигурацию получаемого продукта: например, разложение втор-бутилхлорсульфита в диоксане происходит с полным сохранением конфигурации, а в толуоле наблюдается полная инверсия. Для объяснения этого эффекта был предложен ион-парный $SNi$ - механизм, включающий ионизацию связи $S—C1$ в скоростьопределяющей стадии. Судьба образовавшейся ионной пары зависит от природы растворителя. Если растворитель достаточно основен, он может стабилизировать ионную пару, сольватируя ее с тыльной стороны, приводит к сохранению конфигурации. Растворитель с низкой сольватирующей способностью (толуол) не может стабилизировать ионную пару и происходит замещение $SO_2$ ионом $Cl^-$ с тыльной стороны, происходит полная инверсия.
Другие примеры реакций, идущих по SNi механизму
Другим примером реакций, которые идутх по $SNi$ механизму являются другие замещения галогенидами:
-
Серы

В случае первичных и вторичных спиртов возможно образование побочных продуктов - диалкилсульфитив. Очевидно, что для третичных спиртов образования полного эфира затруднено стерическими препятствиями:
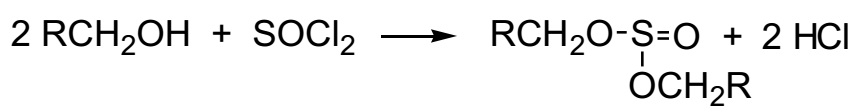
На стадии моноалкил-эфира возможно внутримолекулярное нуклеофильное замещения по SNi механизму.
-
Замещение галогенидами фосфора.
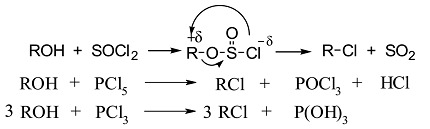
Реакции проходят через образование эфиров:

Аллильная перегруппировка ( SN’)
Аллильные соединения реагируют с нуклеофилами легче, чем насыщенные аналоги. Эти реакции часто сопровождаются перегруппировкой и обозначаются $SN’.$ Общая схема аллильной перегруппировки имеет следующий вид:

Перегруппировка может идти по механизму $SN1$ ИЛИ $SN2$ (обозначается как $SN2$’). Считается, что на самом деле аллильные перегруппировки идут по согласованному механизму $SN2$’ и по син- процессу, т.е. син- $SN2$’- механизму: