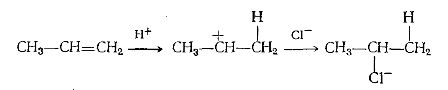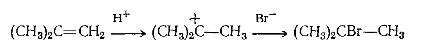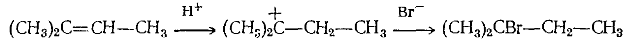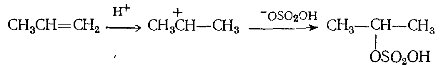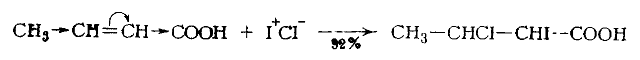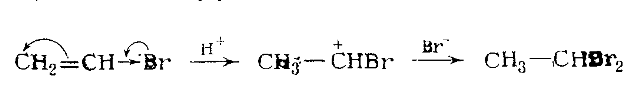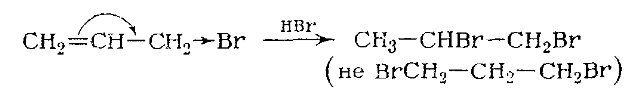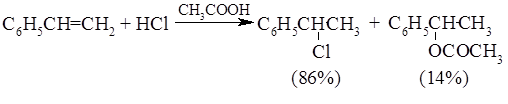Другой реакцией электрофильного присоединения к алкенам является давно известное гидрогалогенирование алкенов.
Галогенводороды присоединяются к алкенам, причем порядок реакционной способности здесь тот же, что и в их реакции со спиртами:
$HI > HBr > HCl$
Этилен присоединяет $HI$ и $HBr$, но не присоединяет менее реакцион-носпособный $HC_1$. Пропилен присоединяет хлористый водород, и про-дуктом реакции является хлористый изопропил, но не хлористый н-пропил. Эти факты очень легко объяснить двухступенчатым процессом транс-присоединения, аналогичным присоединению брома:
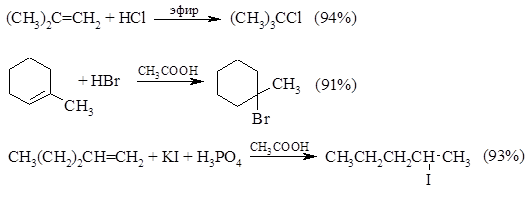
Ниже приведены типичные примеры присоединения $HCl$, $HBr$ и $HI$ к различным алкенам:
Влияние заместителей на присоединение галогеноводородов к алкенам
Такие реакции лишь на первый взгляд кажутся простыми. На самом деле они имеют очень сложный механизм, детали которого остаются неясными до сих пор. Влияние алкильных заместителей у двойной связи на скорость присоединения описывается следующей последовательностью:
$R_2C=CHR ≈ R_2C=CH_2 > RCH=CHR ≈ RCH=CH_2$
Вначале атака пропилена протоном (в данном случае являющимся электрофильным агентом) приводит к образованию не первичного, а более устойчивого вторичного карбониевого иона, и, таким образом, продукт, образующийся в результате присоединения иона хлора, представляет собой хлористый изопропил. В тех случаях, когда цис- и транс-присоединения могут привести к различным продуктам, неизменно получается продукт транс-присоединения. Пропилен более реакционноспособен, чем этилен, так как электроноотталкивающее влияние метильной группы увеличивает чувствительность к атаке электрофилом.
В данной реакции третичный карбониевый ион образуется предпочтительно по сравнению с первичным. В других же реакциях третичный карбониевый ион образуется предпочтительно по сравнению с вторичным карбониевым ионом:
Серная кислота (при 0°С) легко присоединяется к олефинам тем же путем:
Зная механизм реакции, легко сделать вывод о направлении присоединения. В 1869 г., задолго до того как этот механизм был выявлен, Марковников сформулировал эмпирическое правило, которое сумми-ровало все известные в то время факты, а также факты, открытые впоследствии. Согласно правилу Марковникова, при присоединении $H+X$ ~ или $Br+OH$ ~ положительный ион присоединяется к ненасыщенному углероду, связанному с меньшим числом алкильных групп. Теперь известно, что присоединение именно к этому атому обусловлено тем, что углеродный атом, связанный с большим числом алкильных заместителей, приобретает положительный заряд.
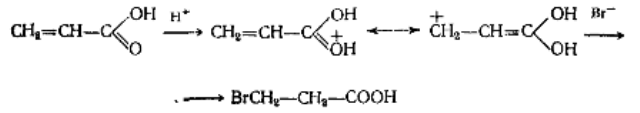
Реакцию акриловой кислоты с бромистым водородом с образова-нием $\beta$-бромпропионовой кислоты можно объяснить начальной атакой вещества протоном и распределением положительного заряда между двумя резонансными структурами:
В реакции присоединения хлористого иода к кротоновой кислоте (реакция 6) более электроположительный атом иода (менее электрофильный) соединяется с альфа-углеродным атомом, который вследствие поляризации более электроотрицателен (прямые стрелки указывают индукционные эффекты):
Присоединение бромистого водорода к бромистому винилу протекает в направлении, обратном ожидаемому на основании сильного электронопритягивающего эффекта атома брома, что следует из медленного присоединения брома.
В этом случае присоединение, по-видимому, определяется сдвигом пары электронов от брома в направлении, противоположном направлению индукционного эффекта:
Ни индукционный, ни резонансный эффекты поляризации не яв-ляются чем-то постоянным; в зависимости от полярности реагента или растворителя возможны некоторые изменения. Поэтому, когда два эффекта действуют в противоположных направлениях, предсказать направление реакции особенно трудно.
В бромистом аллиле смещение электронов, вызванное неподеленными электронами брома, подобное смещению в реакции присоединения бромистого водорода к бромистому винилу, невозможно из-за отсутствия двойной связи, способной передавать эффект, и присоединение протекает обычным образом через более устойчивый промежуточный карбониевый ион:
Перегруппировки в реакциях гидрогалогенирования алкенов
Для реакций присоединения галогеноводородов, протекающих по $AdE_2$-механизму, характерна конкуренция процессов сопряженного присоединения и перегруппировок, поскольку в качестве интермедиата образуется ионная пара или карбокатион:
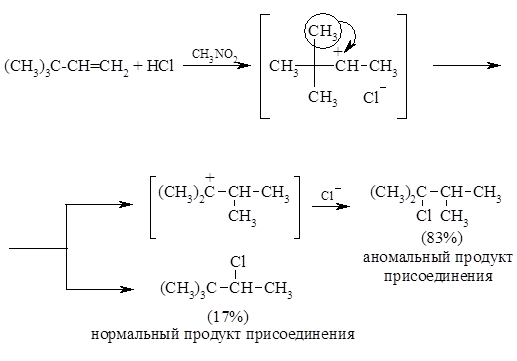
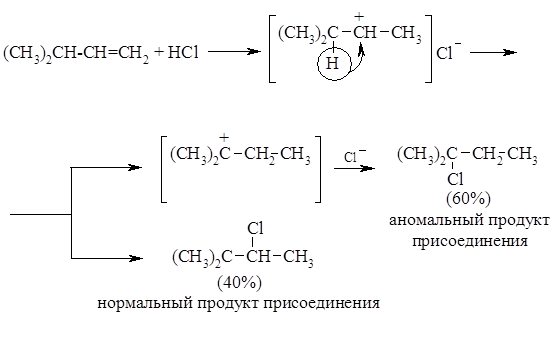
Примером перегруппировок с 1,2-миграцией алкильной группы и гидрид-иона являются реакции гидрогалогенирования соответственно трет-бутилэтилена и изопропилена:
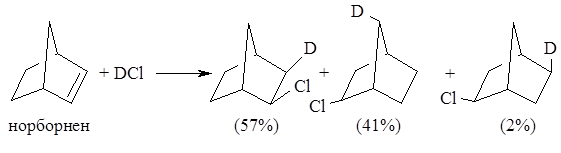
Для реакций присоединения галогеноводородов к напряженной двойной связи характерны скелетные перегруппировки с участием карбокатионов в качестве интермедиатов. Движущей силой такого рода перегруппировок является образование более стабильного или близкого по стабильности карбокатиона. Классическим примером скелетных перегруппировок является присоединение к норборнену (бицикло[2.2.1]-гептену-2):
Присоединение $DCl$ к норборнену дает экзо-норборнилхлорид; при этом около половины продукта образуется в результате скелетной перегруппировки норборнилкатиона. Экзо-положение хлора также находится в соответствии с ионным механизмом присоединения. Преобладание неперегруппированного экзо-норборнилхлорида указывает на то, что большая часть ионных пар дает ковалентный продукт, прежде чем образуется совершенно симметричная ионная пара.
Перегруппировки, часто наблюдающиеся при присоединении галогеноводородов к алкенам и циклоалкенам, снижают синтетические возможности и ценность этой реакции. Более удобный способ получения вторичных и третичных алкилгалогенидов заключается во взаимодействии спиртов с галогеноводородом, тионилхлоридом или комплексом трифенилфосфина с галогеном или четыреххлористым углеродом.