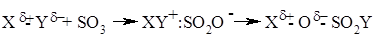Поскольку переходные состояния имеют практически нулевое время жизни, их невозможно наблюдать непосредственно и об их геометрии можно только делать заключения на основании косвенных данных. Часто такие заключения бывают вполне основательны. Например, в реакции типа $Sn_2$ между $CH_3I$ и $I^-$ (реакция, при которой продукт идентичен исходному соединению) переходное состояние должно быть совершенно симметричным. Однако во многих случаях невозможно прийти к таким легким выводам, и тогда на помощь приходит постулат Хэммонда, который гласит: геометрия переходного состояния похожа на геометрию тех веществ, к которым оно ближе по свободной энергии, и это относится к каждой стадии реакции. Так, в случае экзотермической реакции, подобной изображенной на рис. 1, переходное состояние больше похоже на реагенты, чем на продукты, хотя здесь разница не слишком велика, так как величина с обеих сторон значительна.
Использование постулата Хэммонда для объяснения состояний интермедиатов
Этот постулат очень полезен при рассмотрении реакций, в ходе которых образуются интермедиаты.
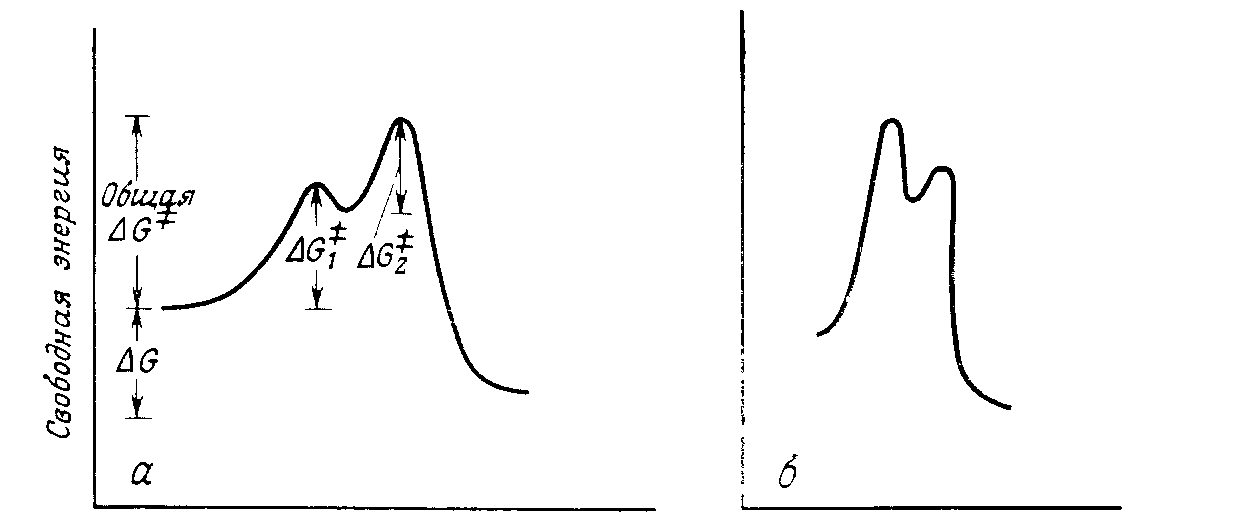
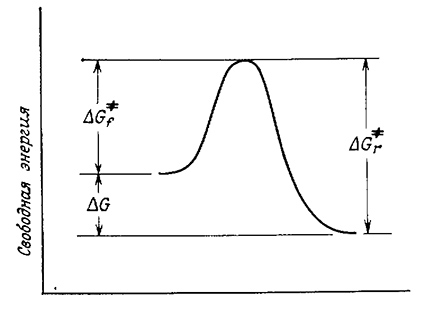
Реакции, в которых образуются интермедиаты, являются двухстадийными (или многостадийными) процессами. Для них характерно наличие так называемой энергетической ямы и двух переходных состояний, каждое из которых обладает более высокой энергией, чем интермедиат (рис. 2). Чем глубже яма, тем устойчивее интермедиат. На рис. 2, а второй пик выше первого, а на рис. 2, б изображена обратная ситуация. Следует отметить, что в реакциях, где второй пик выше первого, общая величина $ΔG$ меньше суммы величин $ΔG$ для двух стадий. Минимумы на диаграмме свободной энергии соответствуют реальным частицам, имеющим хотя и очень корот-кое, но конечное время жизни. Это могут быть карбокатионьц карбанионы, свободные радикалы и тому подобные частицы, , а также молекулы с обычными валентностями составляющих их атомов. В любом случае в условиях реакции это короткоживущие частицы (так как $ΔG_2$ мало). которые быстро превращаются в продукты. Однако максимумы на кривых соответствуют не реальным частицам, а переходным состояниям, в которых связи частично разорваны и (или) частично образованы. Переходные состояния существуют только как переходные, их время жизни близко к нулю.
В реакции, показанной на рис. 2, а, первое переходное состояние по энергии намного ближе к интермедиату, чем к реагентам, поэтому можно предполагать, что и геометрия его больше похожа на геометрию интермедиата, а не на геометрию реагентов.
Точно так же второе переходное состояние по величине свободной энергии намного ближе к интермедиату, чем к продуктам, и потому по геометрии больше похоже на интермедиат, а не на продукты. О структуре интермедиатов обычно известно больше, чем о структуре переходных состояний, поэтому сведения об интермедиатах часто используются для того, чтобы сделать заключения о переходных состояниях.
Использование постулата Хэммонда в реакциях присоединения
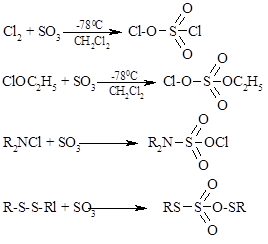
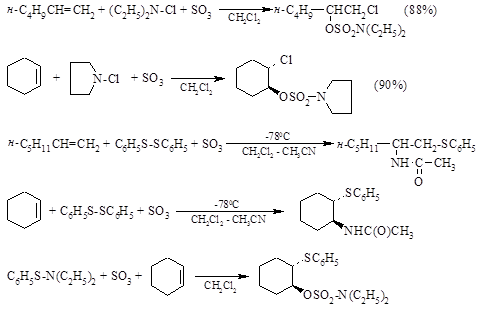
Существует несколько способов увеличения «эффективности электрофильности» реагента, присоединяющегося к двойной связи алкена по ионному механизму. Один из них заключается в замене частицы Y в реагенте $X^δ+ - Y^δ-$ на более электроотрицательную группу или анион $Y- = BF_4-; SbF_6--; ClO_4-; FSO_3-$. Такое резкое возрастание «эффективности электрофильности» реагента происходит, например, при замене сульфенхлорида $RSCl \ на \ RS^+BF_4- \ или \ RS^+SbF_6- $или при переходе от ацетата ртути $(CH_3COO)_2Hg$ к $(CF_3COO)_2Hg$ или к $(CF_3SO_3)_2Hg$. другой путь увеличения электрофильности реагаента состоит в электрофильном катализе кислотой Льюиса. Эта идея лежит в основе реакций электрофильного присоединения к двойной связи алкена, катализируемых оксидом серы (Н.С. Зефиров, А.С. Козьмин и др., 1982). Первоначально $SO_3$ действует как кислота Льюиса, затем происходит перегруппировка аддукта $XY+:SO_2O- \ в \ X – OSO_2Y$, что формально соответствует внедрению серного ангидрида по связи X – Y с образованием нового реагента:
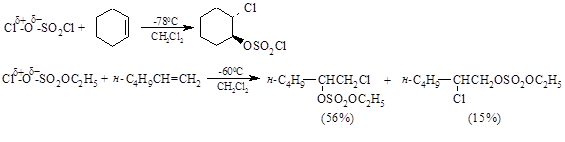
Связь $X^δ+ - O^δ- \ в \ X – O – SO_2 – Y$ гораздо более полярна, чем связь $X^δ+ - Y^δ-$, и такой сульфонат оказывается более сильным электрофилом, чем исходный реагент X – Y, например:
В этих модифицированных реагентах атом хлора или группа $SR$ оказывается положительным концом диполя и выполняет роль электрофильной частицы:
N,N-диалкилхлорамины $R_2NCl$ и дисульфиды $RSSR$ присоединяются к двойной связи по радикальному механизму, однако модификация их с помощью $SO_3$ изменяет механизм с радикального на электрофильный: