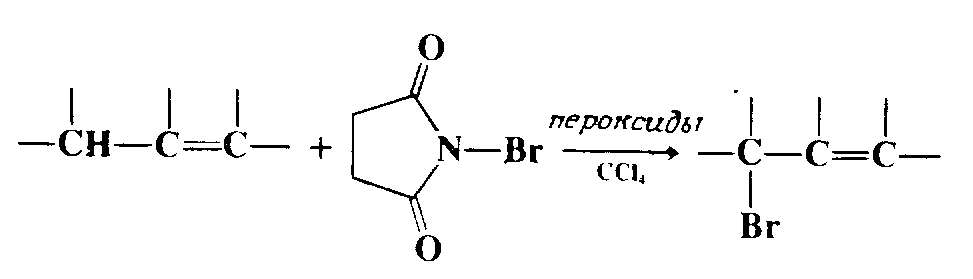
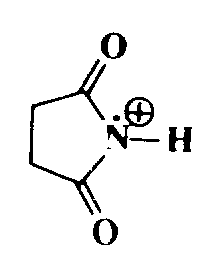
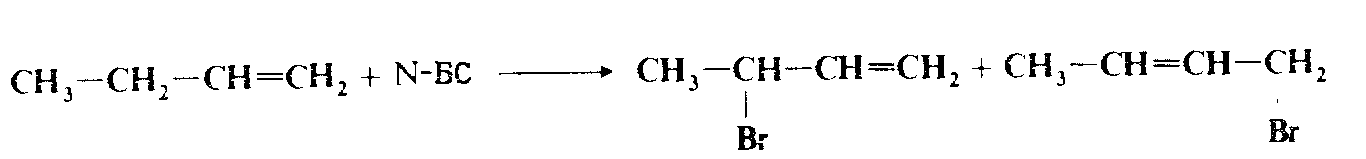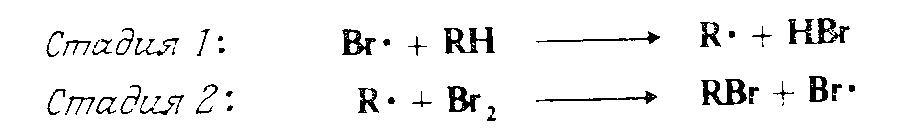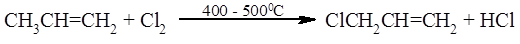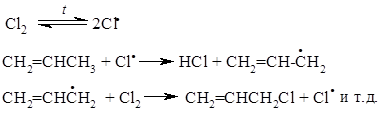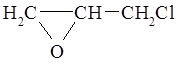Приведенная реакция представляет в сущности частный случай реакции галогенирования алкенов, но она имеет и самостоятельное значение и потому рассматривается отдельно. Галогенирование олефинов по аллильному положению можно осуществить под действием многих реагентов, из которых чаще всего используется $N$-бромосукцинимид (англ. сокращение NBS, рус. сокращение N-БС). В этом случае процесс носит название реакции Воля — Циглера, или бромирования по Волю Циглеру. Для реакции применяют неполярные растворители, обычно $CCl_4$. Из других $N$-бромоамидов использовались различные $N$-бромогидантоины и $N$-бромокапролактам. Аллильное хлорирование изучено в гораздо меньшей степени, оно проводится под действием $N$-хлоросукцинимида, $N$-хлоро-$N$-циклогексилбензолсульфамида или трет-бутилгипохлорита. При использовании других реагентов в реакции необходимо применять инициатор, обычно это пероксиды или реже УФ-облучение.
Селективность реакции
Как правило, реакция специфична относительно аллильного положения и продукт получается с высоким выходом. Однако, если промежуточно образующийся аллильный радикал несимметричен, может наблюдаться аллильный сдвиг и в результате образуется смесь двух возможных продуктов, например.
Если при двойной связи имеются два разных $alpha$-положения, как, например, в $CH_3CH — CHCH_2CH_3$, водород у вторичного атома углерода замещается легче, чем у первичного. Относительная реакционная способность водорода при третичном атоме углерода не ясна, хотя описано много реакций замещения при третичном аллильном положении. Удается провести бромирование с обеих сторон от двойной связи. Благодаря электроноакцепторным свойствам брома второй атом брома легче присоединяется с другой стороны двойной связи, а не в α-положение к первому атому брома.
$N$-Бромосукцинимид оказывается также высокорегиоселективным бромирующим агентом относительно других положений, в том числе ос-положений к карбонильной группе, к тройной связи, к атому бора и к ароматическому кольцу (бензильное положение). Когда в одной молекуле имеются и двойная и тройная связи, замещение преимущественно происходит по $\alpha$-положению к тройной связи. Региоселективность N-БС можно существенно повысить, меняя растворитель.
Механизм аллильного бромирования
То, что механизм аллильного бромирования носит свободно-радикальный характер, было показано Даубеном и МакКоем, которые нашли, что реакция очень чувствительна к свободнорадикальным инициаторам и ингибиторам и не происходит в отсутствие хотя бы следов инициатора. В их работах было показано, что частицей, которая действительно отрывает водород от субстрата, является атом брома. Реакция инициируется малыми количествами радикала $Br$; как только он образуется, главные стадии роста цепи имеют вид:
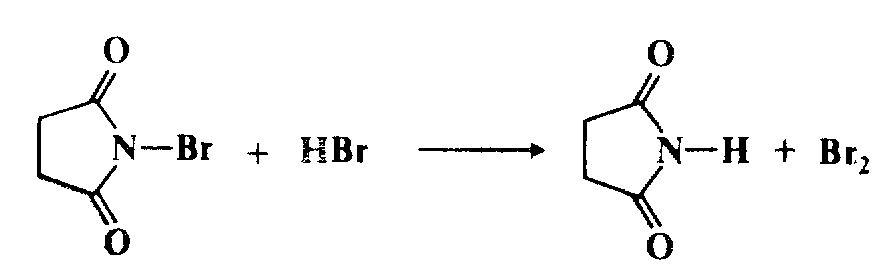
Молекулярный бром образуется в результате быстрой ионной реакции между N-БС и $HBr$, выделяющимся в стадии 1:
Таким образом, функции N-БС сводятся к обеспечению источника $Br_2$ в низкой стационарной концентрации и к использованию выделяющегося в стадии 1 $HBr$. В пользу этого механизма свидетельствует тот факт, что N-БС и $Br_2$ проявляют близкую селективность; кроме того, различные $N$- бромоамиды также имеют близкую селективность, что согласуется с гипотезой о том, что в каждом случае реагирующей является одна и та же частица.
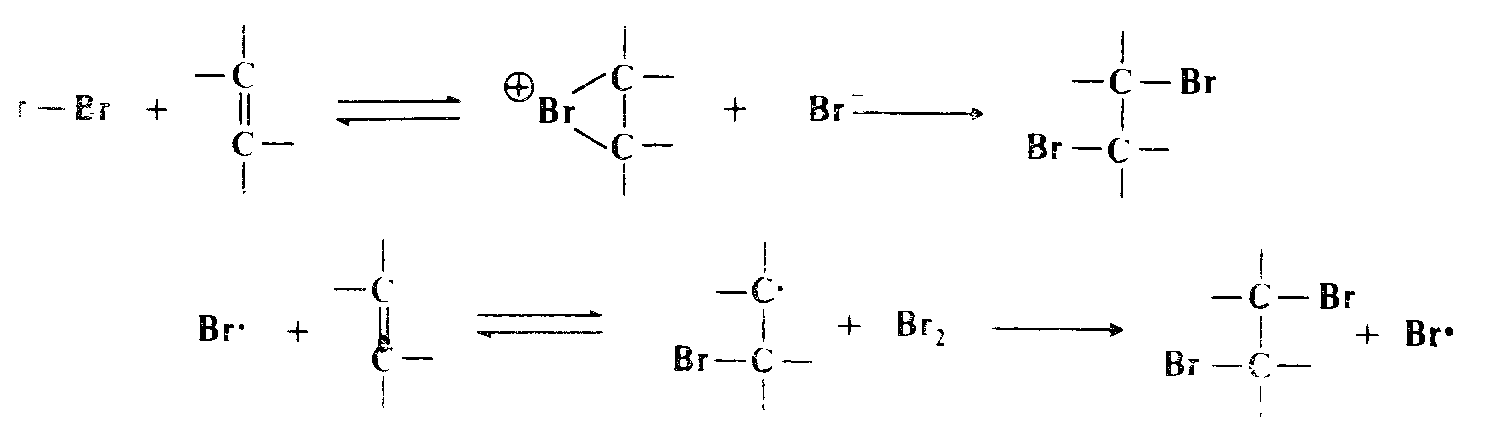
Может возникнуть вопрос, почему же $Br_2$, если он является реагирующей частицей, не присоединяется по двойной связи либо по ионному, либо по свободнорадикальному механизму. По-видимому, причиной служит низкая концентрация брома. При бромнровании двойной связи только один атом атакующей молекулы брома связывается с субстратом независимо от того, по какому механизму происходит присоединение, по электрофильному или свободнорадикальному:
Второй атом брома поставляется другой бромосодержащей молекулой или ионом. Если концентрация брома достаточно низка, вероятность того, что подходящая частица окажется в непосредственной близости от интермедиата, очень мала. В любом случае интермедиат возвращается в исходное состояние, что открывает путь конкурентной реакции аллильного замещения. Если это рассуждение справедливо, должна существовать возможность бромирования олефина по аллильному положению без конкурентного присоединения даже в отсутствие N-БС или других аналогичных агентов, если поддерживать очень низкую концентрацию брома н удалять $HBr$ по мере образования, с тем чтобы подавить конкурентную стадию присоединения. Это было подтверждено экспериментально.
В полярных растворителях механизм может быть совершенно другим, включающим электрофильную атаку ионом $Br+$. В протонирующих растворителях отрывающей частицей может служить протонированный радикал:
Аллильное хлорирование проводилось под действием $N$-хлоросукцинимида в присутствии таких катализаторов, как арилселенилхлориды $ArSeCl$, арилдиселениды $ArSeSeAr$ или $TsNSO$. При использовании селеновых катализаторов с высокими выходами получались перегруппированные аллилхлориды; при использовании $TsNSO$ образовывались неперегруппированные аллилхлориды с низким выходом. Свободнорадикальный механизм в этих реакциях маловероятен.
Прямое газообразное хлорирование
Реакцией, родственной аллильному галогенированию по Циглеру считается прямое газообразное хлорирование пропилена при 400 – 500 ºС:
В настоящее время эта реакция лежит в основе промышленного способа получения хлористого аллила в больших количествах. В таких условиях присоединение хлора к двойной связи становится обратимой реакцией, где равновесие сильно смещено в сторону исходных реагентов. С этой реакцией успешно конкурирует прямое радикальное замещение водорода в аллильном положении:
Аллилхлорид используется для получения эпихлоргидрина
и других соединений с аллильной группой.
Таким образом, реакции радикального замещения водорода в аллильном положении, как и реакции радикального присоединения по двойной связи, столь же типичны для алкенов, как и процессы электрофильного присоединения по кратной связи.