Представления о жестких и мягких кислотах и основаниях Р.Дж. Пирсона
В настоящее время используется концепция, выдвинутая Пирсоном, что все кислоты и основания можно разделить на два класса -- мягкие и жесткие. Для них справедливо правило: мягкие кислоты связываются с мягкими основаниями, жесткие кислоты -- с жесткими основаниями.
-
Мягкие кислоты имеют большой размер и маленький положительный заряд ($Cu^+$, $Ag^+$, $Au^+$, $Hg^+$, $Pt^{2+}$, $Br_2$, $I_2$ и др.).
-
Жесткие кислоты характеризуются малым размером и большим положительным зарядом ($H^+$, $Mn^{2+}$, $Fe^{3+}$, $CO^{3+}$ и др.). Они могут выступать только в роли акцепторов электронов.
-
Мягкие основания являются сильными восстановителями ($H^-$, $I^-$, $S^{2-}$, $CO$, $R_2S$ и др.).
-
Жесткие основания являются сильными окислителями ($F^-$, $Cl^-$, $OH^-$, $NH_3$, $H_2O$ и др.).
-
К промежуточным кислотам относят двухзарядные $d$ - ионы ($Fe^{2+}$, $CO^{2+}$, $Ni^{2+}$ и др.) и промежуточные основания ($Br^-$, $SO_3^{2-}$ и др.).
Отличительные свойства мягких и жестких кислот и оснований
Понятия жесткий и мягкий не тождественны понятиям сильный и слабый.
Важнейшие характеристики и примеры жестких и мягких кислот и оснований приведены в таблице
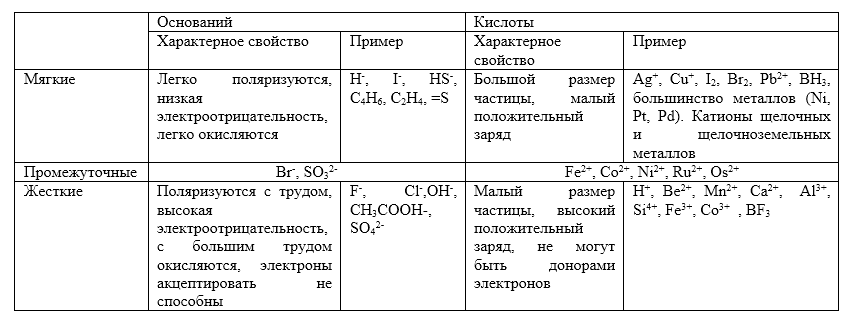
Рисунок 1.
Классификация реакций с позиции теории жестких и мягких кислот и оснований
С позиции теории мягких и жестких кислот рассматривают следующие реакции:
-
Реакции, связанные с переносом электрона
$[FE(cN)_6]^{4+} + Cu^+ > [Fe(CN)_6]^{3+} + Cu^{2+}$
или протона
$H_3O^+ +NH_3 > H_2O + NH^{4+}$
-
Реакции образования аддиционных соединений (реакция между кислотой и основанием. В общем виде:
$A + :B > A:B$
-
Нуклеофильное замещение. Частица -- нуклеофил (анион или молекула) $B:`$ несет неподеленную пару электронов, за счет которой образуется новая связь. Молекула $AB$ испытывает атаку нуклеофила, $:B$ является уходящей группой.
$B:` + AB > B`A + :B$
-
Электрофильное замещение. Электрофильный агент А, имеет незавершенные электронные оболочки и стремится их заполнить. Молекула $BA$ испытывает атаку электрофила.
$A` + BA > A`B + A$
Связь жестких кислот с жесткими основаниями происходит за счет ионных сил. Мягкие кислоты связывают мягкие основания с помощью ковалентных связей. Чтобы ковалентная связь была достаточно прочной, необходимо, чтобы атомы были близкими по значениям электроотрицательности и размерам.
Это широко используется в практических целях:
-
Объясняет, почему в природе алюминий встречается в виде оксида, гидроксида и силикатов, медь, ртуть -- в виде сульфидов, кальций -- в виде карбоната. Металлы переходных элементов VIII группы, как мягкие кислоты катализируют реакции в которых принимают участие мягкие основания (оксид углерода). Более мягкие основания (соединения мышьяка и фосфора) являются каталитическими ядами, так как могут образовывать прочные соединения с этими металлами и блокировать их активные центры.
-
Объясняет ядовитость угарного газа для человека. Угарный газ образует с двухвалентным железом гемоглобина более устойчивое соединение, чем кислород.
-
Аналогично угарному газу действуют ионы тяжелых металлов ($Pb^{2+}, Hg^{2+}$), которые вступают во взаимодействие с $SH$ - группами физиологически важных соединений, способны выключать их функции.
В рядах соединений $d$ -- элементов жесткость кислоты может меняться в зависимости от степени окисления.
В тетракарбониле никеля $Ni(CO)_4$ никель является мягкой кислотой, никель со степенью окисления $+3$ -- жесткая кислота, а со значением степени окисления $+2$, будет занимать промежуточные положение.
Количественные соотношения в теории жестких и мягких кислот и оснований
Представление о мягких и жестких кислотах и основаниях можно выразить формулой
где $K$ -- константа равновесия реакции донора $D$ с акцептором $A$;
$S_A S_D$ -- параметры, определяющие силу ($pK$) кислоты и основания;
$\sigma_A$ и $\sigma_D$ -- их жесткость (или мягкость).
Эффективным является уравнение, выражающее энтальпию образования $\triangle H_AD$ аддукта из акцептора и донора:
где параметры $E$ характеризуют ионное взаимодействие;
$c$ - характеризует ковалентную связь.
При этом считают $E = b\mu$, $c = aR$,
где $\mu $ -- дипольный момент молекулы;
$R$ -- поляризуемость молекулы;
$a$ и $b$ -- эмпирические константы.
Для использования уравнения, отображающего энтальпию образования аддукта, необходимо найти значения, определяемые опытным путем.












