Общие положения кислотно -- основного катализа
Кислотность и основность соединений определяет их реакционную способность.
Согласно определениям Бренстеда и Лоури, кислота -- это вещество, отдающее протон, а основание -- вещество, которое протон присоединяет. Донорами и акцепторами протонов могут выступать как электронейтральные молекулы, так и ионы. Сопряженные пары кислот и оснований изображает реакция:
где $AH$ -- кислота;
$H^+$ - протон;
$A^-$ - основание;
$K-a$- константа кислотности.
Свойство кислот отдавать протон характеризуется константой кислотности $pK_a$. в водных растворах ее значение для протонных кислот лежит в широких пределах.
Примеры кислот и сопряженных с ними оснований: $N{H_4}^+$, $NH_3$; $H_2O$, $OH^-$; $HSO_4^-$, $S{O_4}^{2-}.$
По определению Льюиса кислотой является любое соединение, способное присоединить электронную пару, а основанием -- соединение, способное электронную пару отдать. Тогда все электронодефицитные соединения будут являться кислотами $(AlCl_3$, $BF_3$, $S_nCl_4)$ или основаниями (фосфины, амины, сульфиды, карбанионы).
Кислотно -- основный катализ вызван протолитической реакцией между кислотой и основанием и катализатором. Основная его особенность -- переход протонов от катализатора к реагенту и обратно.
Так, при кислотном катализе протон переходит от катализатора к молекуле реагирующего вещества. При основном катализе первоначально катализатор служит акцептором протона или донором аниона по отношению к молекуле реагента.
С ростом константы диссоциации кислот и оснований активность катализаторов в кислотно -- основном взаимодействии возрастает.
По типу кислотно -- основного катализа протекают реакции
- гидратации;
- дегидратации;
- этерификации;
- гидролиза;
- поликонденсации и др.
Электрофильные и нуклеофильные реагенты
Электрофильность и нуклеофильность являются характеристиками реакционной способности веществ, которые участвуют в бимолекулярных гетеролитических реакциях. Одна из частиц, электрофил, выступает акцептором пары электронов, а другая -- нуклеофил, донором электронов.
Скорость гетеролитической реакции будет тем больше, чем более ярко выражены электрофильные и нуклеофильные свойства.
Электрофильные свойства увеличиваются при отщеплении протона от реагента основанием. Электрофильные и нуклеофильные свойства способны изменяться при комплексообразовании реагента с кислотой Льюиса.
Роль кислот и оснований в реакциях кислотно -- основного типа как катализаторов заключается в том, что они способны образовывать с реагентом промежуточное соединение в результате донорно -- акцепторного взаимодействия. В молекуле промежуточного соединения появляются реакционные центры, имеющие повышенную или пониженную электронную плотность, что способствует облегчению взаимодействия центрам с электрофильными или нуклеофильными молекулами второго реагента.
Классификация каталитических реакций кислотно -- основного типа
Все реакции кислотно -- основного типа в зависимости от природы частиц, выполняющих функции катализатора делят на группы:
-
Специфический кислотный катализ. Содержит реакции, катализируемые ионами водорода.
Пример 1Гидролиз сложных эфиров в присутствии минеральных кислот. Включает присоединение протона к карбоксильному кислороду в результате донорно -- акцепторного взаимодействия. Образовавшийся карбоний -- катион обладает высокой электрофильностью, поэтому способен реагировать с водой. В ходе нескольких последовательных стадий образуется спирт, кислота и протон, способный вновь вступать в реакции.
-
Специфический основный катализ. Включает реакции, катализируемые ионами гидроксила. Промежуточными соединениями выступают анионы, образующиеся в результате присоединения основания или в результате отрыва катализатором протона от реагента.
Пример 2Альдольная конденсация в присутствии гидроксил -- ионов протекает в несколько этапов:
- отщепление протона и образование енолят -- иона.
- присоединение енолят -- иона к карбонильной группе другой молекулы.
- отщепление протона от растворителя, образование продукта реакции и регенерация катализатора.
-
Общий кислотно -- основный катализ. Включает реакции, катализируемые кислотами и основаниями Бренстеда. В активации молекулы реагента принимают участие электрофильные частицы и кислоты Льюиса, которые выступают в качестве протона.
Пример 3Реакция Фриделя -- Крафтса (алкилирование ароматического кольца) катализируется хлоридом алюминия $AlCl_3$ в среде неполярного растворителя. Сначала образуется поляризованная молекула промежуточного соединения, возникает электрофильный реакционный центр. Этот центр вступает во взаимодействие с молекулой бензола с образованием $\sigma $- комплекса, один из атомов углерода переходит из состояния $sp^2$-гибридизации в $sp^3$-гибридизацию. Образуется продукт и катализатор.
-
Электрофильно -- нуклеофильный катализ. Содержит реакции катализируемые донорами или акцепторами электронных пар.
Пример 4Гидролиз сложного эфира в присутствии имидазола -- типичный пример нуклеофильного катализа. Имидзол взаимодействует с эфиром и этим облегчает реакцию с водой. Молекулы промежуточного соединения сильно поляризуются и обладают большой реакционной способностью. В качестве нуклеофильных катализаторов могут выступать амины, ионы галогенов, некоторые анионы.
Зависимость константы скорости от функций кислотности
Реакции в органической химии могут катализироваться как кислотами, так и основаниями.
Экспериментально кислотно -- основный катализ легко распознать по кривым зависимости логарифма константы скорости от $pH$, $H_0$ и других функций кислотности. Частный случай такой зависимости: двухстадийная реакция. Одна стадия ингибируется при добавлении кислоты, а другая в это время ускоряется.
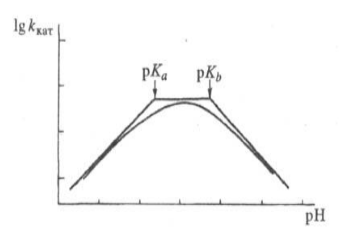
Рисунок 1.
В реакции кетонов с гидроксиламином образование аминов будет замедляться в кислой среде. Это происходит из-за дезактивации гидроксиламина протонированием. Дегидратация, вторая стадия, катализируется кислотой и будет замедляться при высоких $pH$.












