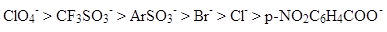Устойчивость карбокатионов оценивается с помощью экспериментальных и теоретических методов.
Экспереминтальное определение стабильности карбокатионов
Экспериментально находят константы равновесия карбокатионов ($pKR$) по отношению к недиссоциированной форме, связанной с устойчивостью ионов. Так, для трифенилметил-катиона $pKR$ составляет -6.6 в кислых условиях (в 50% серной кислоте), -0.8 для трис-4-метоксипроизводного, 9.4 для трис-4-диметиламинозамищеного катиона. Последний в хлоридной форме известен как кристаллический фиолетовый, стабильный даже в разбавленных водных растворах. Для циклического тропилиевого катиона $pKR$ 4.8.
$R + + H2O ⇄ ROH + H +$
$КR = [ROH] [H +] / [R +]$
$pKR = -lg KR$
Оценка стабильности карбокатионов по энергиям стабилизации
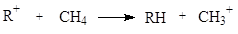
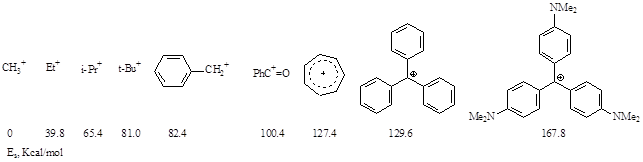
Стабилизацию карбокатионов можно оценивать также по энергиям стабилизации, которые получают по тепловому эффекту изодесмичной реакции (тогда сравнение ведется с метил-катионом):
Изодесмические реакции - виртуальные или реальные преобразования, которые сопровождаются сохранением в продуктах числа однотипных связей.
Приведенные данные показывают, что стабилизация карбокатионов достигается за счет положительных индукционного (алкил-катионы) и мезомерного (бензил, бензоил, трифенилметилы) эффектов.
Карбокатионы тем устойчивее, чем больше компенсированный заряд и чем больше делокализований заряд.
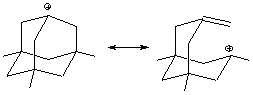
Кроме индукционных и мезомерных эффектов в стабилизации карбокатионов участвует также гиперконьюгацийний эффект. Так, триметиладамантилкатион образует стабилизированную форму с разрывом одного из циклов.
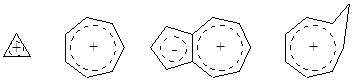
Примеры стабильных карбокатионов
Примеры стабильных карбокатионов: алил-, бензил-, триарилметильный катионы, кристаллический фиолетовый (трис-п-диметиламинотрифенил-метилхлорид), малахитовый зеленый (бис-п-диметил-аминотрифенилметилхлорид), бриллиантовый зеленый (бис-п-диэтил-аминотрифенилметилхлорид).
Время жизни $CH_{3^+}$ - очень мало, но третичных ионов - намного больше. Трудно генерировать ионы с центром в голове моста бициклоалканов (1-адамантил-катион).
Карбокатионы стабилизируются цеолитами, которые имеют свойства подобные кислотам Бренстеда или Льюиса. В таком варианте устойчивыми становятся даже такие ионы, как триарилметильный, циклопентенильный и тому подобные.
Циклопропений-, тропилий катионы, азулен, гомоциклооктатриенил-катион (образуется из циклооктатетраену протонированием).
Другие параметры, характеризующие стабильность карбокатионов
На уровень стабилизации карбокатионов указывают также:
энтальпии ионизации - $CH_3Br$ (214 ккал/моль), $CH_2=CHCH_2Br$ (152), $PhCH_2br$ (147);
энергии диссоциации связи $C-X$: $CH_3Br$ (67 ккал/моль), $CH_2=CHCH_2Br$ (45), $PhCH_2Br$ (50).
При диссоциации через катион-радикалы (перенос электрона от алкилгалогенида на электрофил) энергия диссоциации сильно снижается. Сольватация тоже ведет к значительному снижению энергии диссоциации.
Ряд отходящих групп:
Плохими уходящими группами являются -$OH$, -$OR$. Для их отщепления нужны сильные кислоты.
Корреляции между константами скорости мономолекулярных реакций замещения и элиминирования не всегда соответствуют эффекту растворителя.
Потенциалы ионизации радикалов тоже указывают на уровень стабилизации создаваемых карбокатионов (чем меньше значение, тем стабильнее карбокатионы).
$СН_3.$ (227 ккал/моль) > $CH_2=CH.$ (218) > $CH_3ch_2.$ (202) > циклопентадиенил. (200) > $CH_2=CHCH_2.$ (188) > $(CH_3)_2CH.$ (182) > $PhCH_2.$ (179) > $(CH_3)_3C.$ (172) > $Ph_2CH.$ (169) > $Ph_3C.$ (167) > циклогептатриенил. (152).$
Реакционные характеристики карбокатионов
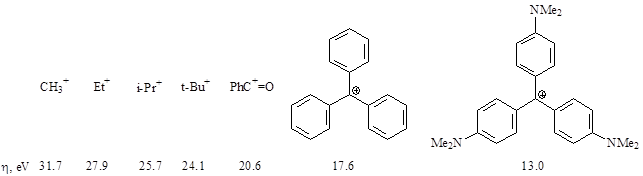
Общий уровень электрофильности карбокатионов предположительно может быть оценен с помощью шкалы химической жесткости. Химическая жесткость - это разница между ионизационных потенциалом и сродством к электрону ($I-A$ в эВ). Точность такой оценки достаточно высока, чтобы сказать, в каком порядке меняются величины в ряду аналогов. Но конечно реакционная способность зависит также от партнера, растворителя, условий проведения процесса.
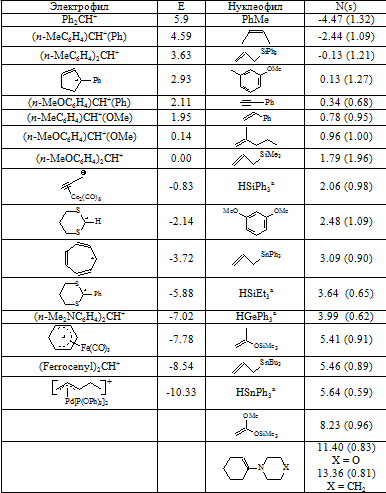
Точнее уровень электрофильности оценивают на экспериментальной основе. Так, созданы шкалы фильности реактантов. По шкале Майра константа скорости реакции зависит от величин $N$ и $E$ (нуклеофильности и электрофильности). Показатели электрофильности $E$ для некоторых карбокатионов представлены ниже (коэффициент s зависит от природы нуклеофила).
$log k (20^\circ C) = s(N + E)$
Шкала Майра покрывает область реактивности в 30 порядков величин как для электрофилов, так и нуклеофилами.
В табл.1 приведены данные параметров Е и N для ряда карбокатионов и для некоторых нуклеофилов.
$a$ - реагирует путем гидридного переноса