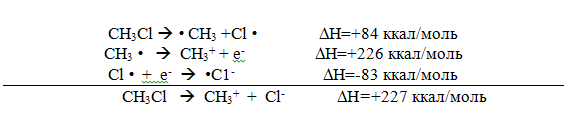Карбокатионы можно генерировать как в газовой фазе, так и в растворе; известны также твердые соли карбокатионов. Для изучения карбокатионов используют различные методы; выбор метода обусловлен физическим состоянием иона, временем его жизни, природой требуемой информации (простое детектирование иона как неустойчивого интермедиата, или количественные данные о структуре и устойчивости карбокатиона).
Образование карбокатиона в газовой фазе в результате ионизации $R-X$ связи с образованием ионов $R^+$ и $X^-$ происходит эндотермически, с высокой положительной энтальпией реакции. Например, энтальпия реакции ионизации молекулы $CH_3Cl$ в газовой фазе определяется следующими термодинамическими стадиями:
Энтальпия стадий (1) и (3) представляет собой табличное значение энергий связей $C-Cl$ в молекулах $CH_3Cl$ и сродство к электрону атомов хлора. Энтальпии превращений метил-радикалов в метил-катионы в стадии (2) определяются масс-спектрометрически как потенциалы ионизации радикалов R. В таблице ниже приведены значения энергий ионизаций в газовой фазе различных $RCl.$
Энтальпии ионизации $RC_1$ в газовой фазе:
$RC_1 -> R^+ + Cl^-$
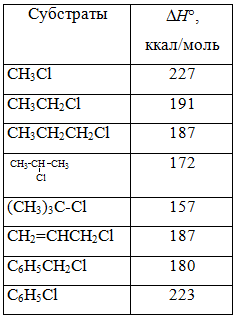
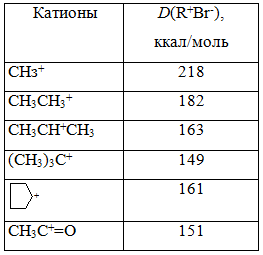
Энергии гетеролитической диссоциации в газовой фазе молекул RBr
Чтобы оценить устойчивость карбокатиона на основе ион-цик-лотронного резонанса была разработана методика, позволяющая измерить энергию разрыва связей $C-Br$ в молекулах $RBr$. Значения энергий этих ионизаций приведенны в табл. 2, они также служат мерой относительной устойчивости карбокатиона в газовой фазе.
Энергии гетеролитической диссоциации в газовой фазе молекул $RBr$
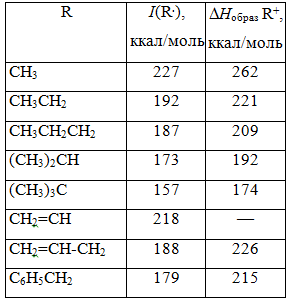
Потенциалы ионизации и теплоты образования карбокатионов
Если не учитывать экзотермические процессы превращений радикалов $X.$ из $RX$ в анионы $X^-$ , то теплоты образования карбокатионов $R^+$ в результате одноэлектронных окислений по реакции $RX - e^- -> R^+ + X.$ могут быть рассчитаны из уравнения:
$A = I(R.) + D(RX)$,
где $A$ — теплоты образования карбокатионов $R^+$,
$I(R.)$ — потенциалы ионизации радикалов (в реакции $R. - e^- -> R^+,)$
$D (RX)$ — энергии гомолитической диссоциации $RX.$
Величину потенциала ионизации $I(R.)$ непосредственно можно определить - зная потенциал ионизации радикала $I(R.)$ и теплоты образования радикалов $R.$, можно рассчитать теплоты образования карбокатиона $R^+$. В табл. 3 приведены значения потенциалов ионизации и теплоты образования для некоторых карбокатионов.
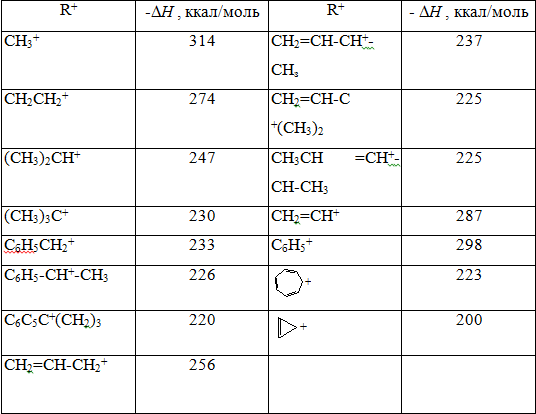
Сродство карбокатионов к гидридиону
По другому методу карбокатион получают протонированием алкенов, на основании анализа значения теплот образования различных карбокатионов получаемых этим методом можно определить сродство карбокатионов к гидридиону (табл. 4):
$R^+ + H^- -> RH + \triangle H°$ ккал/моль,
где $\triangle H°$ — сродство $R^+$ к гидридиону $H^-.$
Анализируя данные, представленные в табл. 1-4, можно сделать вывод, что в ряду третичный > вторичный > первичный > метил относительная стабильность карбокатионов уменьшается. В этом же ряду уменьшаются скорости реакций нуклеофильного замещения в растворах.