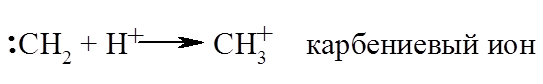Электрофильные реакции алканов находят все большее применение. Они, например, лежат в основе ведущих процессов нефтепереработки и нефтехимии.
Ключевой позицией при рассмотрении механизмов этих преобразований, является природа активации парафиновых молекул.
Экспериментально была доказана возможность активации насыщенных структур их протонированием с образованием карбокатионов, содержащих пентакоординованые атомы углерода, способствовала развитию суперкислотной теории протонирования Ола. В этой теории прежде всего привлекает то, что она не проводит различий между степенью легкости протонирования $C-H$-связей при первичных, вторичных или третичных атомах углерода, а следовательно, допускает, по сути, равноправное возникновение первичных, вторичных и третичных карбокатионов. Наоборот, в силу стерических затруднений в доступе протона к третичному атому углерода или связей, которые его окружают, приоритетным, или исключительным, в полостях твердых катализаторов, может оказаться протонирование $C-H$-связей именно метильных групп, как таковых, находящихся в тесном контакте с протонными центрами. Серьезным аргументом в пользу такого подхода результаты работ Соммера с соавторами, в которых показано, что на кислотных цеолитах в молекуле изобутана дейтерообмену подлежит водород исключительно только метильных групп.
Опираясь на эти известные факты, а также исходя из новых экспериментальных данных, сделана попытка сформулировать новую систему взглядов на механизмы протекания исследованных реакций и проанализировать эти механизмы с точки зрения соответствия прогнозируемого и реально найденного распределения продуктов того или иного преобразования в качестве критерия адекватности новых подходов и новых механизмов.
Рассмотрение механизм электрофильных реакций алканов при помощи пентакоординированных структур
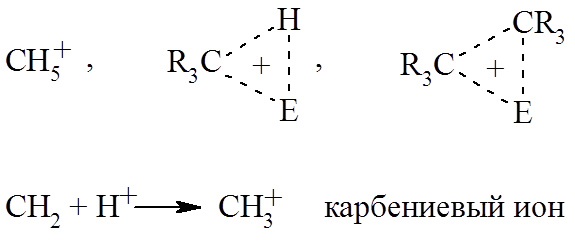
В предыдущей главе уже было рассмотрено пентакоординированное состояния углерода:
К ним также относятся и другие частицы имеющие «неклассическую» структуру. Катион такого типа называется карбониевым ионом.
Так трехкоодинированная частица $R_3C^+$ – это классический ион, в котором связь между каждой парой соседних атомов осуществляется парами электронов. Катион такого типа называется карбениевым ионом, так как формально его можно рассматривать как протонированный карбен:
Ион типа $CH_{3^+}$ можно называть также карбокатионом (так же, как и ион типа $CH_{5^+}$). Раньше термин «карбониевые ионы» использовался для соединений с трехвалентным углеродом, так как еще не были известны электрофильные реакции алканов.
К электрофильным реакциям насыщенных углеводородов относятся реакции катализируемые кислотами:
- изомеризацая углеводородов,
- фрагментация
- циклизации
- электрофильное нитрование,
- электрофильное галогенирование
- и некоторые другие реакции.
Особенности механизма электрофильных реакций алканов
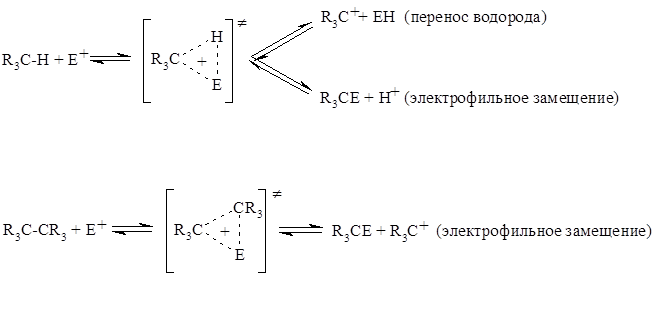
В основе реакционной способностей связей $C–H$ или $C–C$ в таких реакциях лежит их способность организовывать карбониевый ион емеющий пентакоординированную структуру. Последующее расщепление трехцентровых связей ведет к образованиям трехвалентных карбокатионов (ионов карбения) и продуктов замещения (а также продуктов переноса водорода):
Переходные состояния являются «треугольными», т.е. циклическими трехцентровыми двухэлектронными. Это следует, во-первых, из предполагаемой структуры иона метония (которая была рассмотрена ранее), а во-вторых, из простых молекулярно-орбитальных представлений.
Переходные состояния
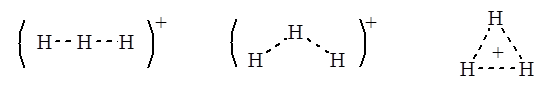
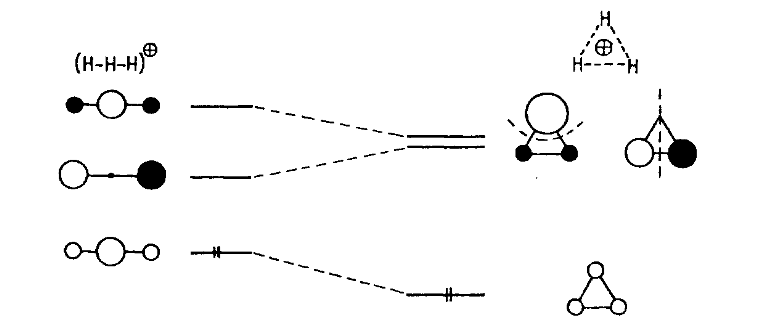
Рассмотрим для простоты в качестве моделей переходных состояний протонированные молекулы водорода H3+ в линейных, угловых или треугольных формах:
Угловые формы являются промежуточными между линейными и треугольными, их стабильность будет промежуточной, поэтому ограничимся рассмотрением лишь линейных и треугольных форм.
Для решения вопроса - какая из этих форм стабильнее - воспользуемся методом возмущений молекулярных орбиталей. На рис. 1 приведена корреляционная диаграмма, связывающая уровни МО линейных и треугольных структур.
Молекулярные орбитали линейных молекул $H_{3^+}$ строятся из $1s$-орбиталей трех атомов водорода каждая; они аналогичны $\pi$-орбиталям аллильных систем. Нижние орбитали $\psi_1$ не имеют узлов. Следующие орбитали имеют один узел, проходящий через центральный атом $H$, верхние орбитали $\psi_3$ имеют два узла (между парой $1s$-атомных орбиталей). При переходе в треугольные формы уровни $\psi_1$ понижаются вследствие возникновения в них дополнительного связывающего взаимодействия между концевыми атомами водорода. Уровень $\psi_2$ повышается, поскольку в треугольной форме между концевыми атомами устанавливается антисвязывающее взаимодействие, которого не было в линейной форме.
Уровень $\psi_3$ понижается, так как возникает связь между концевыми атомами. Орбитали $\psi_2$ и $\psi_3$ треугольной формы имеют по одному узлу (на рис. 1 показано пунктирными линиями) и поэтому вырождены (имеют равную энергию). Поскольку в основном состоянии двухэлектронного иона $H_{3^+}$ орбитали $\psi_2$ и $\psi_3$ пустые, изменение их энергии не учитывается, а учитывается лишь уровень $\psi_1$. Из корреляционной диаграммы следует, что $H_{3^+}$ более стабилен в треугольной форме.