Крекингом называется термическое превращение алканов при температурах 470-540 ${}^\circ$С.
При более высоких температурах (700-1000 ${}^\circ$ С) алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов. Энергия углерод-углеродных связей в алканах близки по величине для первичных, вторичный, третичных и четвертичных атомов углерода (табл. 1) и в жестких условиях пиролиза расщепление любой связи $CH_2 - CH_2$ в нормальных алканах равновероятно.
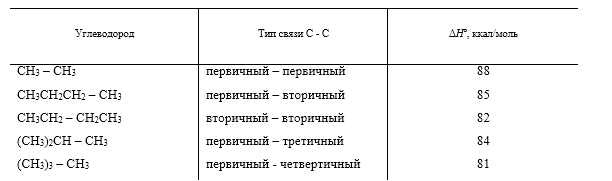
Для разветвленных углеводородов преимущественно происходит разрыв связи у третичного или четвертичного атома углерода.
Виды и особенности крекинга
Различают термическое и каталитический крекинг. Главным объектом при крекинге является расщепление (деструкция) углеродной цепи по связям С-С с одновременным дегидрированием, изомеризацией и циклизацией. При этом образуются главным образом ненасыщенные углеводороды. Строение продуктов крекинга определяется:
- природой исходного алкана
- условиями проведения процесса (температурой, давлением, природой катализатора).
Начальная температура крекинга алканов зависит от их моле кулярный массы. Чем больше молекулярная масса, тем легче расщепляются алканы. В зависимости от длины углеродной цепи относительная скорость крекинга, например по отношению к пентана, равна:
- Количество атомов углерода 5, 6, 7, 8, 10, 20
- Относительная скорость крекинга 1, 4, 9, 10, 32, 120
Существуют такие тенденции разрыва связи С-С: с повышением температуры наблюдается смещение места разрыва к краю молекулы, с повышением давления углеродная цепь расщепляется ближе к середине. Так, из бутана при различных условиях могут образовываться следующие соединения:
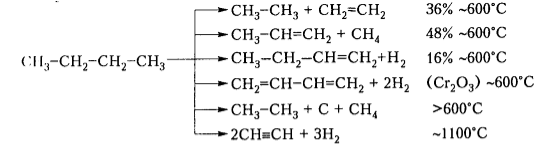
Рисунок 2. Виды и особенности крекинга. Автор24 — интернет-биржа студенческих работ
Термический крекинг
Термический крекинг - свободнорадикальное процесс, в результате которого образуются главным образом ненасыщенные углеводороды (мономеры). При температурах 450-550 ${}^\circ$С алканы расщепляются на свободные радикалы, способны дальше распадаться на более простые метильные и этильные радикалы, например:
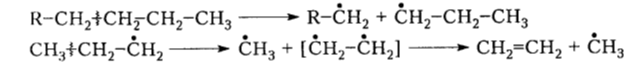
Рисунок 3. Термический крекинг. Автор24 — интернет-биржа студенческих работ
Активные метильные радикалы отщепляют атомы водорода от молекул других алканов с образованием новых свободных радикалов:
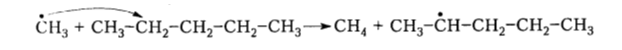
Рисунок 4. Термический крекинг. Автор24 — интернет-биржа студенческих работ
Для таких свободных радикалов при крекинге наиболее характерные реакции, которые в целом формируют природу конечных продуктов, а именно:
-
Реакции $\beta $-распада:
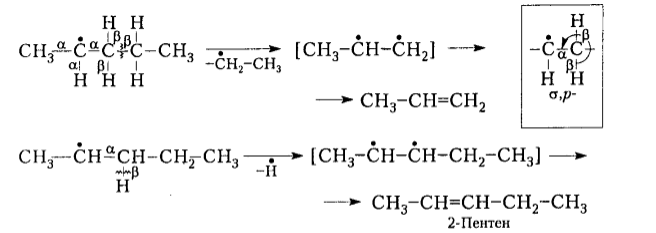
Рисунок 5. -
Реакции диспропорционирования:
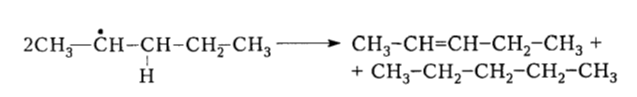
Рисунок 6. -
Реакции обрыва (рекомбинации):
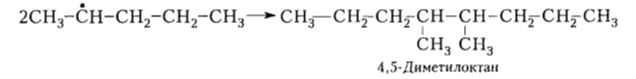
Рисунок 7.
$\beta $-Распад и диспропорционирование свободных радикалов практически всегда проходят по $\beta $-связям относительно неспаренного электрона. Это происходит потому, что $\beta $-связь в известной степени разрыхлена вследствие уменьшения степени перекрывания соответствующих атомных орбиталей. Электронные облака таких $\sigma $-связей С-Н взаимодействуют с неспаренным электроном благодаря эффекту гиперконьюгации ($\sigma $-р-сопряжению).
В условиях пиролиза (высокие температуры) наблюдается глубокий распад алканов с образованием ацетиленовых углеводородов, сажи или кокса, водорода и др.
Каталитический крекинг
Каталитический крекинг применяют главным образом с целью получения разветвленных алканов (моторного топлива) и ненасыщенных углеводородов. В промышленных условиях процесс проходит в присутствии алюмосиликатных катализаторов или кислот Льюиса при 450-530 ${}^\circ$С и примерно атмосферном давлении. Реакция начинается с отщепления гидрид-иона от алкана с образованием карбокатионов, которые благодаря $\beta $-распаду притерпевают дальнейшие изменения:
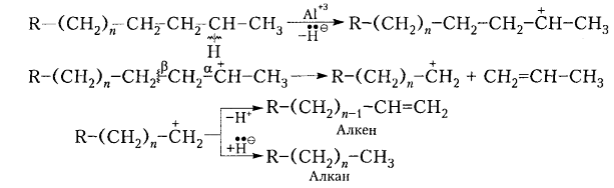
Рисунок 8. Каталитический крекинг. Автор24 — интернет-биржа студенческих работ
Параллельно процессу образования олефинов происходит реакция изомеризации, которая чрезвычайно важна для получения разветвленных алканов, особенно изобутана и изопентана.
Изомеризация алканов в присутствии сильных кислот Льюиса или суперкислот проходит с образованием карбокатионов. Сильная кислота необходима потому, что алканы проявляют малое родство с протоном, поскольку не содержат $\pi $- или n-электронов.
Сначала образуется протонированный алкан с трицентровой двуэлектронной связью у атома углерода, по месту условного присоединения протона, поскольку конкретное место присоединения, как правило, неизвестно. Протонованый алкан быстро превращается в карбокатион, которые путем гидридного и метиланионного перемещений изомеризуются в третичные карбокатионы, то есть в разветвленные алканы:
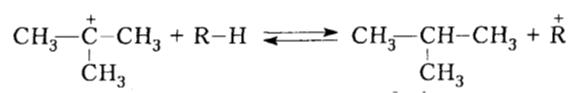
Рисунок 9. Каталитический крекинг. Автор24 — интернет-биржа студенческих работ
Образованные с помощью каталитического крекинга разветвленные алканы - ценные высокооктановые бензины и сырье для получения каучуков.
Алканы в топливе
В двигателе внутреннего сгорания при сжатии бензиновой паров с воздухом алканы нормального строения образуют перекиси, которые вызывают преждевременное возгорание углеводородной смеси. Это явление называется детонацией и наносит вред двигателю.
Разветвленные алканы лишены этого недостатка. Ценные углеводороды с неоструктурой или структурой, подобной структуре изооктана (последнему условно присвоено октановое число 100, а для н-гептана октановое число составляет 0):
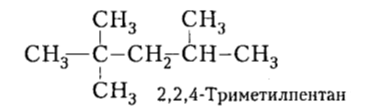
Рисунок 10. Алканы в топливе. Автор24 — интернет-биржа студенческих работ
Итак, если бензин имеет марку, например, 76, то это означает, что ему соответствует октановое число 76 и он проявляет такую же детонационную стойкость, как смесь 76\% изооктана и 24\% н-гептана. Выше октановое число (130} имеет 2,2,3-триметилбутан (триптан).
Топливо для дизельных двигателей характеризуется другим показателем - цетановым числом. Ценные топлива при этом, наоборот, состоят из алканов нормального, неразветвленного строения. Стандартом для дизельного топлива принят цетан $C_{16}H_{34}$ (цетановое число 100).












