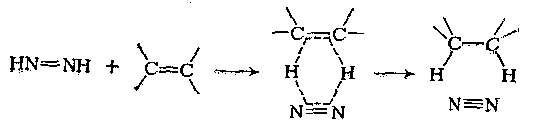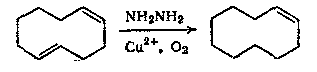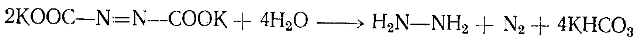Методы поулчения диимида
В другом важном методе присоединения водорода к олефиновым связям используют нестабильную молекулу диимида NH=NH. Были разработаны разные методы получения диимида.
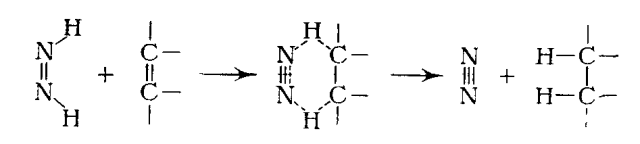
Простые олефины хорошо восстанавливаются этим реагентом, но большинство обычных легко восстанавливаемых функциональных групп, особенно нитро- и карбонильная группы, не подвергаются действию дbимида. Это позволяет восстанавливать двойные углерод-углеродные связи в присутствии других легко восстанавливаемых групп. Механизм реакции представляют как перенос водорода к кратной связи через неполярное переходное состояние с потерей азота:
Простые олефины хорошо восстанавливаются этим реагентом, но большинство обычных легко восстанавливаемых функциональных групп, особенно нитро- и карбонильная группы, не подвергаются действию диимида. Это позволяет восстанавливать двойные углерод-углеродные связи в присутствии других легко восстанавливаемых групп. Механизм реакции представляют как перенос водорода к кратной связи через неполярное переходное состояние с потерей азота:
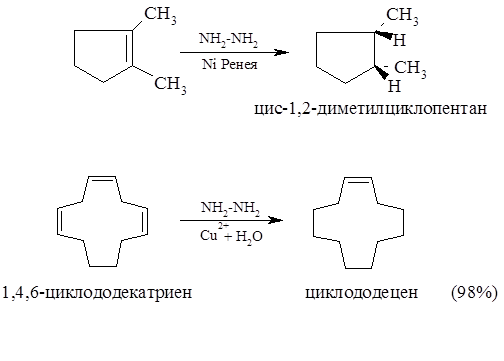
Гидразин NH2−NH2 окисляется пероксидом водорода в присутствии ионов Cu2+ до диимида NH=NH. Более удобным методом генерации диимида является взаимодействие гидразина с никелем Ренея. Если в реакционной смеси присутствует алкен, его двойная связь под действием очень нестабильного диимида подвергается гидрированию. Отличительной особенностью этого метода является строгая син-стереоспецифичность процесса восстановления.
История открытия диимидного восстановления
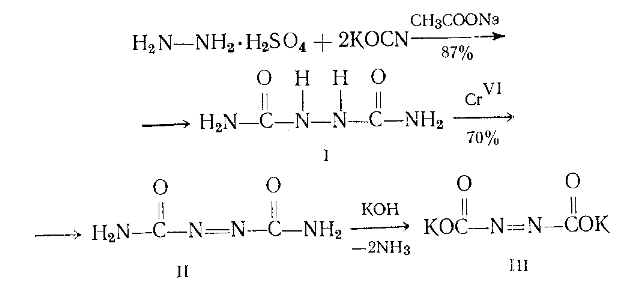
1892 г. Тиле предложил эффективный метод получения гидразопроизводного I, заключающийся в конденсации сульфата гидразина с цианатом калия в присутствии ацетата натрия с дальнейшим окислением продукта I в оранжево-красный азодикарбамат II (диамид азодикарбоно вой кислоты):
При размешивании вещества II в водном растворе едкого кали при охлаждении льдом оно растворялось с выделением аммиака и смесь вскоре превращалась в пасту, содержащую желтые кристаллы калиевой соли азодикарбоновой кислоты (III). Ее кристаллизовали путем растворения в воде при 0 °С и фильтрации раствора в 4—5-кратныи объем охлажденного до 0°С спирта. Тиле рассчитывал, что свободная азодикарбоновая кислота будет разлагаться с выделением двуокиси углерода и образованием диимида HN=NH. Но все попытки выделить это соединение были бесплодными. Калиевая соль азодикарбоновой кислоты (III) быстро и количественно разлагается в воде с образованием гидразина и выделением азота:
Реакция эта первого порядка. Она также катализируется кислотами (Кинг, 1940). Вполне вероятно, что диимид образуется, но он быстро диспропорционируется на гидразин и азот. Фонеру и Хадсону (1958) удалось обнаружить это весьма неустойчивое вещество при масс-спектрометрических исследованиях газообразных продуктов, образующихся при безэлектродном электрическом разряде в токе пара гидразина или азотистоводородной кислоты. Эти исследователи также показали, что диимид существует в твердом состоянии при —195 °С.
В 1961 г. три группы исследователей нашли, что если диимид получать в присутствии олефина или ацетиленового соединения, то он ведет себя как эффективный восстановитель соответствующих кратных связей. Образование диимида из соли Тиле изучалось Кори, а также Ван Тамеленом. Например, избыток динатриевой соли азодикарбоновой кислоты суспендируют в растворе олеиновой или элаидиновой кислоты в метиловом спирте, прибавляют уксусную кислоту для выделения азодикарбоновой кислоты и перемешивают смесь в атмосфере азота в течение 3—12 ч. В обоих случаях с высоким выходом образуется стеариновая кислота. Этим методом азобензол количественно восстанавливается в гидразобензол.
Ван Тамелен показал, что н-толуолсульфонилгидразин также является источником диимида. Для восстановления олефинов их нагревают с этим реагентом 1 ч с обратным холодильником в диметиловом эфире диэтиленгликоля. Диимид восстанавливает симметричные кратные связи C=C, C=C, N=N с большей легкостью, чем полярные связи C=N, C=O, C=N и других.
Восстановление олефинов гидразином было описано Хенусом и Во- ризеком (олеиновая кислота, 1929) и Г. Фишером (винильные группы порфиринов, 1941), но условия реакции не были точно установлены. Предварительные сообщения Эйлуорда и Савистовской (1961 г. и ранее) о восстановлении олефинов гидразином при перемешивании в присутствии воздуха показали, что эта реакция зависит от присутствия кислорода. Результаты систематического изучения этой новой реакции были опубликованы в 1961 г. одновременно Кори и Хюнигом. При изучении восстановления по Кижнеру со-ненасыщенных кетокислот с длинной цепью Хюниг обнаружил, что олефиновая связь в процессе образования гидразона частично восстанавливается, и что эту побочную реакцию можно подавить, удалить из системы кислород. Дальнейшие работы в обеих лабораториях показали, что эффективным восстанавливающим агентом в этой реакции является диимид, образующийся при действии окислителя на гидразин, и что эта реакция активно катализируется ионом двухвалентной меди. Так, комбинация гидразина и Cu2+ с кислородом, перекисью водорода или красной кровяной солью восстанавливает с высокими выходами, например, ундециленовую, малеиновую и фумаровую кислоты, дифенилацетилен, пропиоловую кислоту и азобензол. Восстановление менее реакционноспособной двойной связи холе-стерина протекает лишь с выходом 20%.
Восстановление гидразином и окислителем в присутствии катали-затора представляет собой стереоспецифическую реакцию цис-присое-динения. Это видно из восстановления фенилпропиоловой кислоты цис-коричную кислоту и цис- и транс-стильбена в дейтерирующей системе до мезо- и (±)-1,2-дидейтеро-1,2-дифенилэтана, что доказано озонолизом и окислением до янтарных кислот. Считают, что восстановление диимидом включает передачу двух атомов водорода через циклическое переходное состояние:
Ван Тамелен (1962) изучал влияние стерических особенностей вос-станавливаемого вещества на стереохимическое течение реакций вос-становления диимидом, который образуется в спиртовом растворе смеси олефина и гидразина в атмосфере кислорода при 45-55 °С. В тех случаях, когда е олефине ярко выражено влияние объемистых заместителей, стерические препятствия заметно сказываются на ходе реакции восстановления. При меньшем размере заместителей наблюдаются значительно меньшие стерические ограничения.