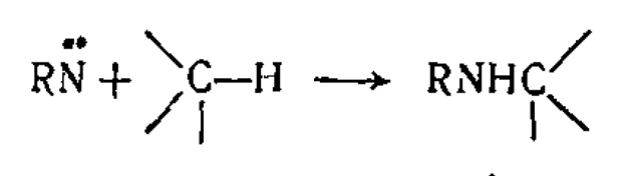Нитрены — нестабильные соединения формально одновалентного азота с общей формулой $RN$:, где $R = Alk, Ar, NR_2', OR', CN$ и др., являются электронными аналогами карбенов. Нитрены являются высокореакционными интермедиатами — азотистыми аналогами карбенов. Как и карбены, нитрены могут находиться как в триплетном, так и в синглетном состоянии. Синглетное состояние присуще молекуле со спаренными спинами и низкоэнергетпческой свободной орбиталью, а триплетное состояние — бирадикал.
Доказательство промежуточного участия нитренов в реакциях, протекающих в растворах, иногда основано на данных кинетических исследований, но чаще на изучении природы выделенных продуктов реакции. Некоторые реакции рассматриваются как реакции, типичные для нитренов. Наиболее важной среди них является реакция внедрения по связи $С—Н$, характерная для синглетных нитренов и для немногих частиц иной природы:
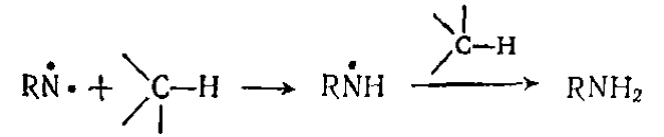
Отрыв водорода — типичная радикальная реакция, в которую вступают триплетные нитрены и в результате которой (в случае нитренов), как правило, происходит генерирование $NH_2$-группы:
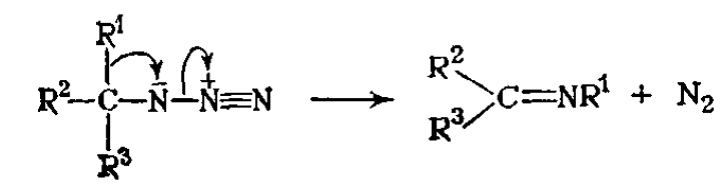
К другим реакциям, в которых могут принимать участие нитрены, относится присоединение к двойным связям и другим нуклеофильным агентам, перегруппировки (особенно заместителей в 1,2- положении), распад и димеризация. Само по себе выделение продуктов любого из этих типов реакций не является достаточным доказательством промежуточного образования нитренов, поскольку предшественники нитренов или другие промежуточные соединения нередко могут давать те же продукты. Примером являются 1,2-сдвиги, которые могут протекать синхронно с выбросом азота из азидов:
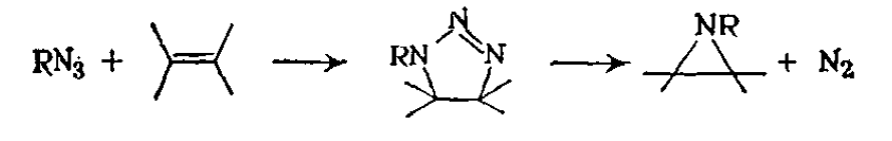
Образование азиридинов из азидов и олефинов, которое может происходить через промежуточное образование неустойчивого триазолина:
Реакции нитренов
Многие нитрены существуют в триплетном основном состоянии. Однако большая часть методов генерирования нитренов, за исключением фотолиза в присутствии сенсибилизаторов, приводит, вероятно, первоначально синглетным частицам в соответствии с принципом сохранения спина. Это означает, что при проведении реакций в растворе могут реализоваться как синглетные, так и триплетные нитрены; степень участия триплетных частиц определяется относительными скоростями захвата синглетной частицы и ее распада до триплета. Еще одно осложнение состоит в том, что, когда синглетное и триплетное состояния близки энергетически, возбужденный триплет может вновь превращаться в синглет.
Предложенный материал, в основном, касается гетероциклических систем, где впервые были полученны стабильные кристаллические нитрены, а значит возникла возможность сравнительного анализа и сопоставления ряда классических реакций с описанными в сегодня их нитреновыми вариациями. Нитрены сейчас могут практически использоваться в индивида дуальном виде (есть уже коммерческие предложения) или генерироваться in situ из доступных пренитренов. В настоящее время нитренные методы синтеза уже приобрели актуальность в синтезе фармацевтических субстанций, в синтезе красителей, а также в других областях. о чем будет речь при дальнейшем вы- жения материала. В этих случаях нитрены могут выступать стехиометрической составляющей, так и выступать в роли катализатора различных реакций.
Реакции автотрансформации
Для понимания природы стабильных нитренов особый интерес представляют реакции автотрансформации, то есть превращение этих соединений без участия других реагентов, только под действием физических воздействий (температуры, света и т.д.). Перегруппировки, включающих миграции групп и атомов в нитреенах, относят к важнейших свойств этих частиц, связанных с уровнем их термодинамической стабильности. Миграции легко осуществляются в простых нитренах. Известно, что низшим нитренам свойственны автотрансформации: обычно это процессы миграции протонов, которые происходят даже при низких температурах, но для гетероциклических нитренов и их ароматических производных эти преобразования найдены только в начале 90-х лет. Следует отметить нестабильность гетероциклических нитренов при нагревании, но направления термических превращений нитренов до недавнего времени не изучались.
Простейшим примером миграций протонов и групп в стабильных карбены нитренов являются реакции $1,2-Н$-сдвига, известные еще с начала 90-х годов. Отмечается мономолекулярный согласованный механизм реакции $1,2-Н$-миграций в малостабильних нитренах и обсуждается альтернативный межмолекулярная механизм. В гетероароматических нитренах возможен только межмолекулярная механизм переноса протона, что подтверждается расчетами. В этих случаях миграция протонов ведет к ароматизации гетероциклов. Внутримолекулярная реакция является энергетически невыгодной. Теоретические расчеты показывают, что энергия активации реакции достаточно велика (40 - 47 ккал / моль), хотя процесс является экзотермическим (-26 - -29 ккал / моль).
Миграции в нитренах - достаточно распространены. Основное направление миграции N-заместителя в нитренах - на нитреновый атом азота. Однако, возможны также реакции в 4 и 5 положения ядра.
Присоединение к кратным связям
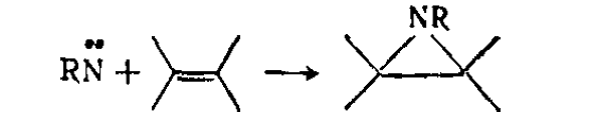
Присоединение нитренов к олефинам — удобный способ получения некоторых типов азиридинов. Присоединение синглетных нитренов представляет собой согласованную реакцию, для которой характерно сохранение стереохимии исходного олефина в продукте реакции, в то время как присоединение триплетных нитренов (менее типичная реакция) приводит к частичной или полной потере исходной стереохимии. Схема присоединения нитренов к олефинам, протекающего с препаративными выходами:
Реакции с ароматическими субстратами
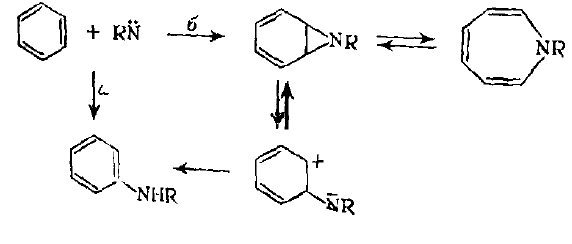
В результате реакции нитренов с ароматическими соединениями бензольной природы образуются два типа продуктов: азепины и продукты замещения. Азепины могут получаться путем циклоприсоедииення нитрена к ароматической системе с последующей валентной таутомеризацией. Образование продуктов замещения может протекать по нескольким механизмам: в результате электрофильного замещения синглетного нитрена или радикального замещения триплетного нитрена, путем прямого внедрения, по реакции отрыва — рекомбинации ароматических $С—Н$-связей или путем перегруппировки промежуточно образующегося циклоаддукта. Таким образом, продукты замещения могут получаться или прямым (а) или косвенным (б) путем:
Реакции внедрения по связям $С-Н$
Наиболее характерной особенностью реакций нитренов (как синглетных, так и триплетных, хотя по разным механизмами) по сравнению с обычными электрофильными и нуклеофильными реагентами, или даже с амбифильними дицентролизованными реагентами, являются реакции внедрения по одинарным связям $C-H$, $X-H$ , $C-X$ (например, $ >N: + R_3C-H → R_3C - (> N-H)$). Механизмы реакций внедрения нитренов в целом аналагичны таким для карбенов.