Общее понятие о кинетическом изотопном эффекте
Кинетический изотопный эффект обусловлен наличием различия скоростей реакций изотопов. Для молекул, которые содержат разные изотопы, скорости химических реакций неодинаковы. Кинетический изотопный эффект можно охарактеризовать выражением
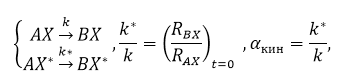
Рисунок 1.
где $k$ - константа скорости реакции.
Кинетический изотопный эффект характеризует отношение константы скорости реакции, в которой присутствует частица с легким изотопом к константе скорости реакции, в которой есть частица с тяжелым изотопом.
Для изотопов водорода скорость химической реакции может отличаться на десятки и сотни процентов. Меньшее отличие наблюдается у изотопов углерода - до $10\%$. Для изотопов более тяжелых атомов эти различия малы.
Например: для изопропилового спирта, имеющего тяжелый водород в $\alpha $-положении скорость окисления гораздо меньше, чем обычного изопропилового спирта.
Кинетический изотопный эффект является внутренним фактором. Его подразделяют на первичный и вторичный кинетические эффекты.
Первичный эффект определен тем, что связь $C-H$ гораздо легче разорвать, чем связь $C-D$ при одинаковом молекулярном окружении. Поэтому, когда переходное состояние требует растяжение связи $C-H$, то замена $H$ на $D$ приведет к уменьшению скорости реакции.
Вторичный кинетический эффект появляется при замене $H$ на $D$ по центру, соседнему с реагирующей связью. Эта замена будет менять электронное окружение связи.
Первичный кинетический изотопный эффект
Основным фактором, приводящим к кинетическим изотопным эффектам, считают различие в нулевых колебательных энергиях для связей с разными изотопами. Масса атомов влияет на энергию, поэтому с увеличением приведенной массы энергия будет уменьшаться. Если два атома связаны ковалентной связью, то их приведенная масса равна
Следовательно, связям $C-^2H$, $O-^2H$, $N-^2H$ в основном состоянии присущи более низкие энергии, чем соответствующим связям $C-H$, $O-H$, $N-H$. Для разрыва связи $C-^2H$ необходимо больше энергии, чем для разрыва $C-H$ при одинаковом окружении.
Скорость реакции замещения водорода на дейтерий будет уменьшаться, если связь с водородом будет оборвана на лимитирующей стадии. Данное явление называется первичный кинетический изотопный эффект.
Скорость реакции почти не изменяется, если связь с водородом разрывается не на лимитирующей стадии.
Например: В приведенных массах различия достигают максимума для изотопов $^1H$, $^2H$ и $^3H$, поэтому первичные кинетические эффекты дейтерия и трития намного больше, чем эффекты в случае других элементов.
Изотопные эффекты дейтерия изменяются от $1$ до $9-10$, а значение тритиевого изотопного эффекта достигает $30.$
При этом значение 1 изотопного эффекта указывает на его отсутствие.
Например: При нитровании бензола и толуола первичный кинетический изотопный эффект отсутствует. Это подтверждается экспериментами с $[^3H]$ толуола, содержащего в кольце тритий и бензола. Заметного тритиевого изотопного эффекта нет и при бромировании данных соединений.
Незначительный изотопный эффект можно наблюдать при сульфировании толуола и бензола, особенно во второй стадии, которая определяет скорость сульфирования $\frac{K_{1H}}{K_{2H}}\sim 2.$
В качестве примера можно привести иодирование $[2,4,6\cdot ^2H_3]$ фенола в ацетатном буфере. Для него величина изотопного эффекта равна $\frac{K_{1H}}{K_{2H}}=4.$ Эта реакция катализируется основаниями и значение изотопного эффекта может достигать $6,5$, тогда скорость реакции определяет вторая стадия.
Величина изотопного эффекта будет значительно варьировать в зависимости от условий реакции.
Подход основания, которое отнимает протон от $\sigma $-комплекса будет значительно затруднен заместителями, особенно пери-заместителем, в положениях $2$ и $8$. Для распада на исходные вещества основание не нужно.
Часть энергетического профиля возле $\sigma $-комплекса показывает, что в случае замены протона на дейтерий увеличение энергии активации потери протона будет меньше энергии активации потери иона нитрония (Рис.3,а).
При сульфировании бензола (Рис.3,б) или в случае реакции
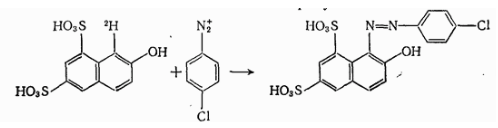
Рисунок 2.
изображенной на диаграмме (Рис.3, в), наблюдаются аналогичные профили энергии.
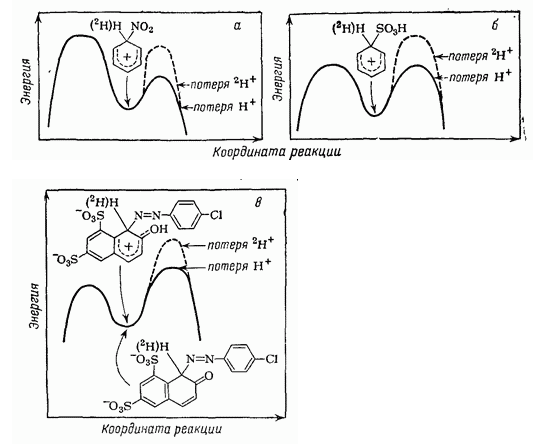
Рисунок 3. Профили энергии в присутствии или отсутствие кинетических изотопных $^2H$ эффектов
Вторичный кинетический изотопный эффект
В реакциях переноса протона о вторичных кинетических изотопных эффектах данных немного.
Модельные вычисления, которые выполнены в предположении неизменности силовых постоянных, прогнозируют, что эффект замещения на дейтерий водородного атома, находящегося по соседству с реакционным центром, не должен быть больше $1-2\%.$
Умеренно большие вторичные эффекты видны при замещении нескольких атомов.
Например: умеренно большой вторичный кинетический эффект в реакциях переноса протона от кетонов к ацетат-ионам. Реакция протекает в $90\%$-ой уксусной кислоте, $\frac{K_H}{K_D}=1,24$. И при первичном, и при вторичном эффектах происходит перенос одного и того же протона (на структурных формулах он подчеркнут).
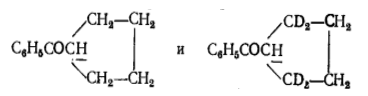
Рисунок 4.
Вторичный изотопный эффект особого типа появляется в случае, если к одному и тому же центру присоединены несколько атомов водорода.
Например: Отщепление $D^+$ от $-CD_{2^-}$ и от $-CHD-$ не абсолютно эквивалентно. Поэтому отношение скоростей ионизации $-CH_{2^-}$ и $-CD_{2^-}$ является одновременно и первичным и вторичным кинетическим изотопным эффектом.
Так как значения вторичных изотопных эффектов намного меньше первичных, их величинами обычно пренебрегают.












