Депротонирование $CH$-кислот
В отличие от электроотрицательных элементов, таких как фтор, азот, кислород, протон от $CH$-кислот отрывается с трудом, что является их характерной чертой.
Одна из самых больших констант скорости реакций в воде - скорость переноса протона между $H_3O^+$ и $OH^-$, равная $1,4.1011$ л/моль.с.
Как протонизация $O-$ и $N$-оснований воздействием $H_3O^+$, так и депротонизация $OH^-$ и $NH$-кислот под действием $OH-$, проходят гораздо медленее, чем реакция $H_3O^+$ с $OH^-$.
Ионы $H_3O^+$ и $OH^-$ переносят протон согласно механизму Гроттгуса: сольватная оболочка ионов сохраняется и протон перемещается по цепочке молекул воды, которые связанны водородными связями. При этом расстояние между $H_3O^+$ и $OH^-$ достаточно большое.
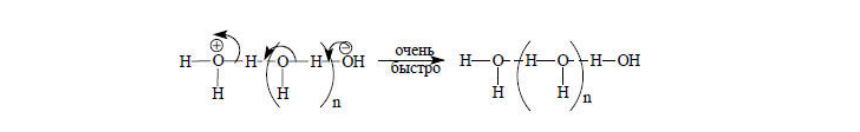
Рисунок 1.
Перенос протона должен происходить быстро, так как ионам $H_3O^+$ и $OH^-$ не надо затрачивать время на сближение друг с другом.
Взаимное влияние донора и акцептора протона в большинстве растворителей (кроме воды) совершается при их тесном контакте. При этом решающим моментом является их способность создавать между собой водородную связь. Донор, акцептор и водородная связь формируют комплекс нужной ориентации. Расстояние, на которое смещается протон тем короче, чем сильнее водородная связь.
Связи $S...H-S$ или $O-H..P$ в реакциях
\[HOCH_2CH_2SH + SCH_2COO^-→ HOCH_2CH_2S^- + HSCH_2COO, K=1,5\cdot 107 л/моль\cdot с;\]\[CHClPO_3H^- + C_6H_5P(CH_3)_2 → CHClPO_3^{2-} + C_6H_5PH^+(CH_3)_2, K=1,5\cdot 107 л/моль\cdot с\]слабее водородных связей между $N$ и $O$, поэтому скорость переноса протона у них меньше, чем для реакций
\[H_3O^+ + OH^- → 2H_2O, K=1,4\cdot 1011 л/моль\cdot с;\]\[H_3O^+ + CH_3COO^- → H_2O + CH_3COOH, K=4,5\cdot 1010 л/моль\cdot с;\]\[H_3O^+ + NH_3 → H_2O + NH_4^+, K=4,3\cdot 1010 л/моль\cdot с;\]\[OH^- + NH_4^+ → H_2O + NH_3, K=3,4\cdot 1010 л/моль\cdot с.\]Скорости переноса протона сильно понижены в случае реакций $CH$-кислот и $C$-оснований:
\[CH_3NO_2 + OH^- → CH_2NO_2^- + H_2O, K=2,8\cdot 101 л/моль\cdot с;\]\[H_3O^+ + (CH_3)_2C=CHOH → H_2O + (CH_3)_2CH-CH^+OH, K=5,9\cdot 10-1 л/моль\cdot с.\]Случаи замедленного переноса протона
Водородное связывание может замедлять перенос протона в случаях
-
если отщепляется протон, который является фрагментом внутримолекулярной водородной связи,
Пример 3Перенос протона в анионе салициловой кислоты от фенольного соединения протекает в $103$ раз медленнее, чем от фенола, так как в переходном состоянии протон связан с атомом В и двумя атомами кислорода. Связи, которые рвутся и образуются не однонаправленны. Энергия переходного состояния выше, чем в отсутствие внутримолекулярной водородной связи, поэтому скорость реакции будет меньше.
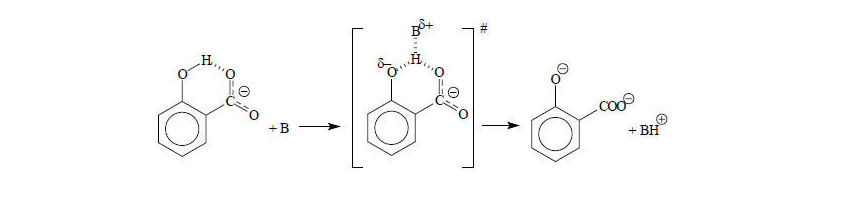
Рисунок 2. -
вследствие пространственных факторов;
Пример 4Соединение $2,6$-ди-трет-бутилпиридин $(I)$ реагирует с $H_3O^+$ в $100$ раз медленнее, чем незамещенный пиридин.
-
наличие внутримолекулярной водородной связи и пространственные затруднения.
Пример 5В соединениях $1,8$-бис-(диметиламино)-нафталин $(II)$ и особенно его $2,7$-диметоксипроизводноем $(III)$ реакция с $H_3O^+$ будет протекать особенно медленно. Группы $(CH_3)_2N$ объемистые, они выталкивают друг друга из нафталиновой системы, в результате чего образуется структура, в которой неподеленные пары атомов азота почти направлены навстречу друг другу. Возникает электростатическое отталкивание и напряжение в молекуле.
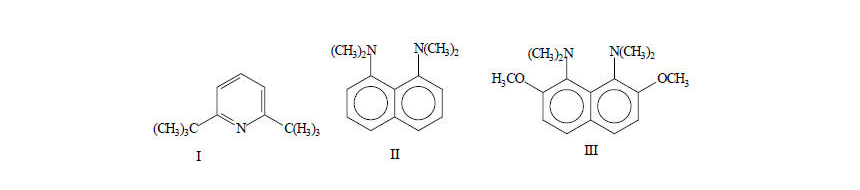
Рисунок 3.Напряжение и отталкивание и в большой степени снимаются при присоединении протона:
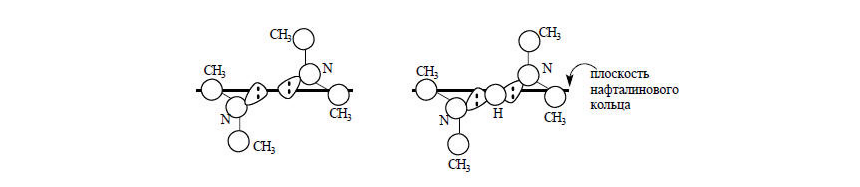
Рисунок 4.В результате производные $1,8$-(диметиламино)нафталина становятся очень сильными основаниями. Для соединения $III$ в воде $pKa=16,3.$ Удалить протон из сопряженных им кислот очень трудно. Еще медленнее происходит отщепление протона от дипротонированной изнутри молекулы криптанда $(IV)$: первый протон отщепляется ионом $OH^-$ со скоростью $1,4.10-8$ л/(моль.с), а второй протон от монокатиона $(V)$ вообще нельзя удалить без разрушения скелета молекулы:
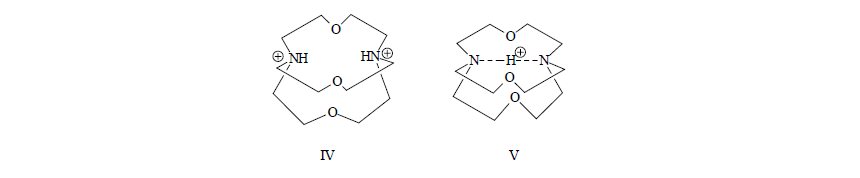
Рисунок 5.
Причины замедленного переноса протона
СН-кислоты являются плохими донорами водородной связи. Ганч в $1899$ г. предложил называть $CH$-кислоты «псевдокислотами».
Причины замедленного переноса протона:
-
Неспособность $CH$-кислот (и $C$-оснований) образовывать сильные водородные связи.
-
Делокализация электронных пар внутри молекулы $CH$-кислоты меняет углы между связями и длины связей, вызывает дополнительные затраты энергии, что, в свою очередь, понижает скорость отщепления протона.
-
Реорганизация окружающего растворителя в результате перераспределения заряда. Отрыв протона от СН-кислот сопровождается сильным смещением заряда к функциональной группе. Перестройка растворителя и энергетические затраты тем больше, чем больше движение заряда.
СН-кислоты могут вести себя как «нормальные» кислоты в случаях, когда ионизация не сопровождается делокализацией заряда. Тогда перенос протона не замедляется.
В большинстве случаев $CH$-кислоты отдают протон основаниям с медленной скоростью и проявляют себя как «псевдокислоты».
Скорость переноса протона от $CH$-кислот к основаниям можно измерить кинетическими методами. Для этого используют реакцию изотопного обмена водорода под действием основания в протонных растворителях. В качестве основания используется соль, имеющая лиатный ион. Обмен производится с меченой $CH$-кислотой в немеченом растворителе или, наоборот с немеченой $CH$-кислотой в меченом растворителе.












