В химических реакциях ароматические углеводороды являются донорами электронов - нуклеофилами, поэтому для них наиболее характерны реакции электрофильного замещения $(SE).$
В реакциях электрофильного замещения атом водорода бензольного ядра замещается на положительно заряженные электрофильные частицы $E^+.$
К важнейшим реакций электрофильного замещения относятся реакции алкилирования, галогенирования, нитрования, сульфирования и ацилирования. Все они идут по общепринятому обобщенному механизму электрофильного ароматического замещения.
Стадии SE реакций
Кинетическими и химическими методами установлено, что электрофильное замещение в бензольном ядре является полярным, двустадийным, бимолекулярным процессом. Т.е. реакции $SE$ имеют ионный характер и протекают в две стадии. Они имеют много общего с реакциями электрофильного замещения алкенов.
-
Первым элементарным актом в этой реакции является атака электрофила на ароматическое ядро, при этом происходит частичное перекрытие его вакантной орбитали с $\pi$-электронной МО бензола - проходит быстрое образование π-комплекса:
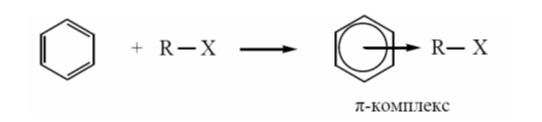
Рисунок 1.Образование $\pi$-комплекса можно установить с помощью электронных спектров: в случае возникновения $\pi$-комплексов в спектрах появляется новая полоса поглощения.
-
На второй стадии $\pi$-комплекс постепенно превращается в $\sigma$-комплекс, который представляет собой карбониевый катион (наиболее медленная стадия реакции):
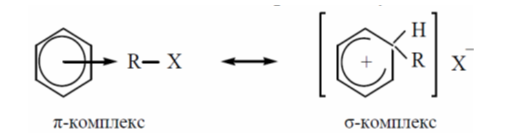
Рисунок 2.
Образование $\sigma$-комплексов
При этом $2 p$-электрона ароматического секстета выходят из сопряжения и образуют новую $\sigma$-связь $(C-R)$, а остальные $4 p$-электрона перераспределяются между пятью атомами углерода. $\sigma$-Комплекс представляет собой сопряженный карбокатион без ароматических свойств, где $5$ атомов углерода находятся в $sp2$-гибридном состоянии, а один - в $sp3$- гибридном состоянии. Оба заместителя $R$ и $H$ лежат в плоскости, перпендикулярной плоскости бензольного кольца.
Образование $\sigma$-комплекса не требует значительных затрат энергии, так как это не переходное состояние молекулы, а реальный промежуточный комплекс. Тем не менее σ-комплекс малостабилен по сравнению с исходной ароматической структурой и легко превращается в бензольное кольцо путем отщепления, как правило, протона $(H +).$
Распределение электронной плотности сопряженного карбокатиона (циклогексадиенил-катиона) в $\sigma$-комплексе можно изобразить тремя резонансными (предельными) структурами:
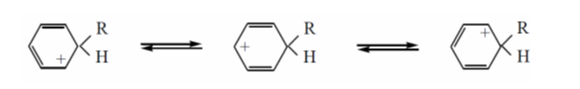
Рисунок 3.
Вследствие незначительной энергии активации образование $\pi$-комплекса он незначительно влияет на направление реакции замещения. Поэтому $\pi$-комплекс часто не учитывается, а рассматриваются только условия образования $\sigma$-комплекса.
Лимитирующая стадия и общий вид $S_E(Ar)$ механизма
Лимитирующей стадией $S_E(Ar)$-реакции является образование π-комплексов (аренониевых ионов).
Поскольку и $\pi$-комплекс и σ-комплекс реально существуют, то считают, что они образуются в виде интермедиатов во всех реакциях идущих по механизму электрофильного ароматического замещения.
На рис. 4 изображена упрощенная энергетическая диаграмма для реакции:
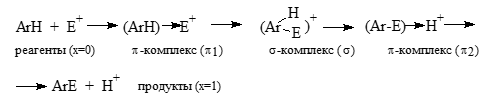
Рисунок 4.
$\pi$-Комплексы изображенные на диаграмме соответствуют интермедиатам образующимся до $\sigma$-комплекса - $\pi_1$ комплекс, и после $\sigma$-комплекса - $\pi_2$ комплекс.
Интермедиат $\pi_1$ образуется на участке между исходным соединением и электрофилом $E^+$, а комплекс $\pi_2$ - на участке между продуктом реакции $(ArE)$ и протоном. Самый высокий энергетический барьер связан с образованием $\sigma$-комплекса.
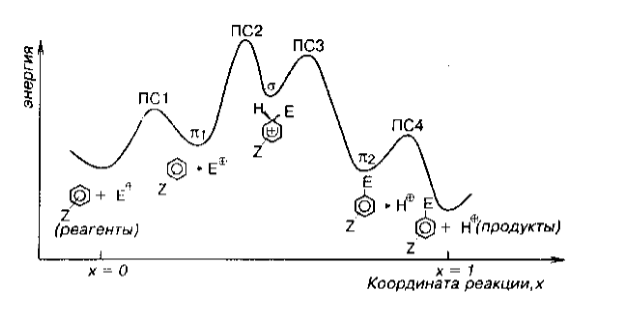
Рисунок 5. Упрощенная диаграмма для $S_E(Ar)$-реакции. ПС - переходные состояния
В данном случае $\pi$-комплекс можно рассматривать как «комплекс с переносом заряда», в которых связь возникает вследствии частичных переносов электронов от аренов к электрофилам.











