
Приближение метода линейной комбинации атомных орбиталей (ЛКАО)
Метод МО ЛКАО основан на следующих правилах.
- При сближении атомов до расстояний химических связей из атомных орбиталей ($АО$) образуются молекулярные.
- Число полученных молекулярных орбиталей равно числу исходных атомных.
- Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
- При перекрывании атомных орбиталей возможно образование и -связи (перекрывание по оси химической связи), и -связи (перекрывание по обе стороны от оси химической связи).
- Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной $АО$.
- На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
- Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
- Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Обычно все многоатомные молекулы и ионы анализировали, исходя из принципа образования ковалентной связи. В приближении метода $ЛКАО$ для описания химической связи между разными атомами можно различным образом выбирать атомное валентное состояние. В зависимости от того, можно ли конфигурацию центрального атома описать линейной структурой, плоским треугольником или правильным тетраэдром, обычно берут валентное состояние центрального атома в гибридизации $sр$, $sр2$ или $sр3$ и полагают, что он образует одинарные связи с $s$-орбиталями (в случае $Н$), с $р$-орбиталями (галогены) или с соответствующим образом гибридизованными орбиталями ($-О-$, $=О$) окружающих атомов. Обычно энергии этих атомных орбиталей различны (рис. 1). Три из четырех $sр3$-гибридизованных ор биталей азота в аммиаке образуют молекулярные орбитали с $Н$, а оставшаяся орбиталь оказывается иесвязывающей. На четырех орбиталях находятся восемь электронов, и на несвязывающей орбитали находится неподеленная электронная пара.
В карбонат-ионе, имеющем форму плоского треугольника, атом $С$ находится в $sр2$-гибридизованном состоянии, а орбиталь $р_z$ образует $\pi$-орбиталь. С другой стороны, три эквивалентных атома $О$ также $sр2$-гибридизованы, а их орбитали $р_z$ представляют собой $\pi$ -орбитали (в ряде приближенных мето¬дов полагают, что атом $О$ $sр$-гибридизоваи, но при этом не возникает различий участвующих в связи орбиталей). Атомы $С$ и $О$ в валентных состояниях образуют показанные на рис. 1.
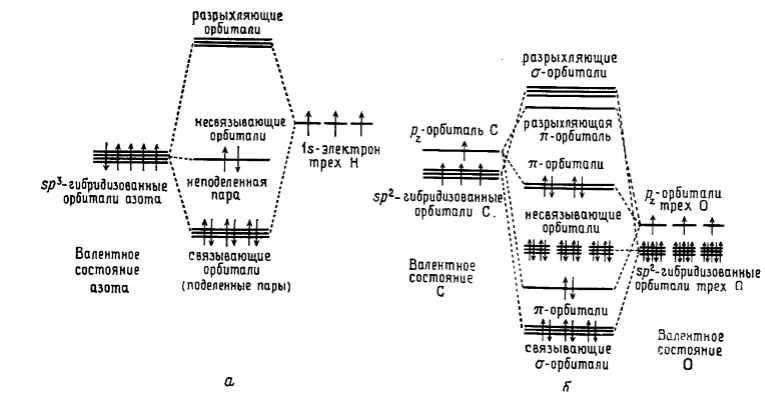
Рисунок 1. Схема молекулярных орбиталей. $а$- аммиак $NH_3$ ; $б$—карбонат-ион $СО_3^2-$,
Молекулярные орбитали, и $\pi$-орбитали расщепляются на трехкратно вырожденные связывающую и разрыхляющую орбитали. Однократное связывание атомов за счет $\pi$-орбиталей приводит к образованию четырех молекулярных орбиталей, две из которых вырожденны. 24 атомных валентных электрона заселяют орбитали, начиная с нижней, и одна молекулярная π-орбиталь и разрыхляющая $δ$-орбиталь оказываются вакантными (карбонат-ион диамагнитен, и все электроны спарены).
Энергия связывающей $δ$ -орбитали, образовавшейся между различными атомами, ниже, чем соответствующих атомных орбиталей, и молекулярная орбиталь обладает характеристиками, подобными атомной орбитали с низкой энергией (велико взаимодействие с другими атомными ядрами). Энергия разрыхляющей $δ$-орбитали выше, чем у каждой атомной орбитали, и она обладает свойствами, подобными атомной орбитали с более высокой энергией. В карбонат-ионе $δ$-орбиталь $δ$-связи локализована в плоскости орбиталей $О$, и взаимодействие с ядром $О$ сильнее, чем с ядром $С$. Это четко проявляется в сдвиге в сторону кислорода участвующих в связи электронов. Напротив, плоскость, в которой локализована молекулярная $\pi$-орбиталь, перпендикулярна плоскости, в которой локализована $δ$-орбиталь, и она обладает совершенно иными свойствами. Обычно стабилизация при образовании молекулярных орбиталей тем больше, чем меньше разность энергий валентных состояний двух атомов.
Энергия связи
Степень снижения энергии определенной связи зависит от типа других связей, в образовании которых участвует данный атом. Например, энергия связи $N—H$ неодинакова в аммиаке, гидразине и органических аминах. Однако в первом приближении величина ее постоянна. Очевидно, если сообщить такую энергию молекуле, связь разорвется, а атомы останутся в тех же состояниях. Энергию многоатомной молекулы можно приближенно представить как сумму энергий связей между отдельными атомами (аддитивность энергий связей). Для вычисления теплот образования большинства соединений удобнее всего брать средние значения, приведенные в таблице.
Энергия связи определяется многими факторами, и трудно усмотреть в ее величинах простые закономерности. Однако можно указать некоторые тенденции.
- Одинарная $δ$-связь между одинаковыми атомами. Наибольшая энергия такой связи во втором периоде у Углерода. У Азота, Кислорода и Фтора она значительно меньше, но различие между ними невелико. В третьем периоде у Фосфора, Серы и Хлора энергия связи больше, чем у Силиция.
- Связи с $H$. Для элементов второго периода она достаточно сильная, для элементов третьего периода значительно слабее. В частности, связь $S—H$ слабее, чем $O—H$.
- Одинарные связи с $O$ и с атомами галогенов. Их энергия связи сложным образом зависит от типа атомов, но есть особо прочные связи ($Si—О$, $Si—F$). С увеличением атомного номера галогена связь ослабляется.
Полярность ковалентных связей
В многоатомных группах электроны, обобществленные различными атомами, поляризуются в определенном направлении и дают дипольный момент, и группа в целом приобретает дипольный момент, соответст-вующий векторной сумме всех дипольных моментов. Например, в диоксиде углерода возникает поляризация типа $C^{\sigma+}—O^{\sigma-}$, но две связи $С—О$ имеют противоположные направления, и в результате взаимной компенсации получается неполярная молекула. Аммиак имеет три поляризованные связи $H^{\sigma+}—N^{\sigma-}$,и их вклад в общий дипольный момент надо умножить на $cos 67,5^°$ (угол связи $N—H$ с осью третьего порядка).
Величины энергии связи между двумя атомами и дипольные моменты являются средними значениями, рассчитанными так, чтобы они наилучшим образом соответствовали значениям дипольного момента большинства молекул. Следуеть заметить, что в ряде случаев наблюдается явление, когда полярная связь находится в молекуле, которая не имеет суммарного дипольного момента ($BF_3$, $CCl_4$ и др.).
В ковалентную связь между двумя атомами, обладающую некоторой полярностью, дает вклад ионная составляющая. При большой разности энергий валентных состояний двух атомов, когда энергия самой ковалентной связи низкая, большой вклад ионной составляющей приводит к упрочнению связи. Это является одной из причин трудности установления определенных тенденций между значениями энергий связи и положением атомов в периодической системе элементов.
Следует также заметить, что на коллективные свойства больших совокупностей многоатомных молекул (температуры плавления, кипения и т. п.), полярность молекул оказывает большое влияние.











