Последовательность заполнения электронных оболочек атомов
Два принципа определяют строение электронной оболочки атома элемента:
-
принцип Паули, который гласит: в атоме может существовать только один электрон с определенным набором квантовых чисел, что учитывает квантовые свойства возможных состояний атома;
-
принципом минимума энергии: при известном суммарном количестве электронов в атоме реализуется состояние с наименьшей энергией. Данный принцип является естественным для существования устойчивого состояния атома. Так как, если состояние атома не является состоянием с наименьшей энергией, то атом может под воздействием внутренних причин перейти в состояние с минимумом энергии.
Анализируя строение атома в первом приближении, пренебрегают энергией взаимодействия электронов. При этом энергию атома приравнивают к суммарной энергии электронов в поле, которое создается ядром атома. Отталкиваясь от данной известной энергии, находят распределение электронов по разным состояниям при учете принципа Паули и минимума энергии. При этом получают идеальную схему заполнения оболочек. Надо отметить, что идеальная схема заполнения может сильно отличаться от реально существующей. Исходя из принципа Паули, максимальное количество электронов (N), которое может находиться в оболочке равно:
где $n$ -- главное квантовое число, $l=0,1..., n-1$ (при заданном $n$) - орбитальное квантовое число.
Энергия электрона в поле ядра растет при увеличении главного квантового числа. Минимальную энергию имеют электроны на $K$ - оболочке ($n=1$), потом на $L$- оболочке ($n=2$) и далее. Что означает последовательное заполнение оболочек, начиная с $K \ (K,L,M,...).$
Надо заметить, что в первом приближении энергия электронов не зависит от орбитального квантового числа, поэтому для того, чтобы объяснить схему заполнения состояний $s,p,d,f...$ требуется учитывать взаимодействие между электронами. При этом получают, что их энергия взаимодействия растет с ростом $l$ (при заданном $n$). В идеальной схеме заполнения оболочки считают, что каждый новый присоединяющийся электрон связывается в состоянии с минимальными квантовыми числами $n,l$, которые допускает принцип Паули.
Правило Хунда
Правило Хунда определяет последовательность заполнения состояний электронов в рамках подгруппы, то есть при одном $l.$ Это правило гласит:
прежде всего, заполняются состояния имеющие разные величины магнитного квантового числа $m$ $(m=-l,-l+1,\dots l-1,l)$, при неизменном значении проекции спина; после того, как все $2l+1$ состояние по магнитному квантовому числу заполнены электронами начинается заполнение электронами, которые имеют противоположную ориентацию спина.
Так, в $p$-состояние ($l=1$) может находиться всего:
При этом состояния заполняются как:
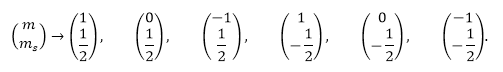
Рисунок 1.
Другими словами правило Хунда можно сформулировать так:
в большинстве случаев электроны в атоме являются неспаренными, по возможности они имеют параллельные спины.
Или:
минимальной энергией обладает терм с наибольшим, из возможных при заданной конфигурации электронов величиной полного спина $(S)$. В том случае, если $S$ задано, то максимальным полным орбитальным моментом $(L)$.
Явление ферромагнетизма железа, кобальта, никеля объясняют как результат следствия правила Хунда. $3d$ - подоболочки данных элементов имеют частичное заполнение, при этом электроны в подоболочках являются неспаренными. В такой ситуации спиновые магнитные моменты не компенсируются. В $Fe$ из шести $3d$ - электронов пять обладают параллельными спинами. В результате каждый атом железа имеет большой суммарный магнитный момент.
Правило Хунда вызвано тем, что электроны в атоме взаимно отталкиваются. В результате энергия атома уменьшается с увеличением расстояния между электронами. Электроны, которые находятся в одной подоболочке и имеют одинаковые направления спинов, имеют разные величины магнитного квантового числа и, следовательно, определяются волновыми функциями с отличными распределениями в пространстве. Получается, что электроны, обладающие параллельными спинами, отстоят в пространстве дальше друг от друга, чем спаренные электроны. Такая конфигурация имеет меньшую энергию и значит, является более устойчивой.
Следствие правила Хунда
Только те атомы могут образовать молекулы, у которых присутствует один или более неспаренных электронных спинов. По правилу Хунда в одной подоболочке электроны имеют столько параллельных спинов, сколько это возможно (то есть направление спина одинаково у максимального числа электронов). При этом все атомы (исключая атомы с замкнутыми подоболочками) обладают неспаренными электронами, следовательно, могут создавать связи (вступать в реакции). Из сказанного выше можно сделать вывод о том, что все элементы с незамкнутыми внешними оболочками могут создавать химические соединения.
Правила Хунда (используются для построения основного терма):
- ниже по энергии расположен терм, мультиплетность которого максимальна;
- если мультиплетности равны, то минимальна энергия у терма, которому принадлежит максимальная величина суммы орбитального момента.
Задание: Объясните, каковы структуры молекул водорода, кислорода и азота?
Решение:
Структура атома $H$ имеет вид:
\[1s\ \left(1.1\right).\]Значит, структура молекулы водорода $(H):$
\[H-H.\]Электронную структуру атома кислорода $(O)$ запишем как:
\[1s^22s^22p^4.\]Во внешней незамкнутой оболочке расположено $4$ электрона которые находятся в состоянии $2p$. Подоболочка $2p$ имеет три разных координатных состояния. Они соответствуют $m=-1,0,1.$ В соответствии с правилом Хунда и принципом Паули, три электрона заполнят данные состояния, обладая параллельными спинами, один электрон будет иметь спин противоположного направления. Получается, что во внешней оболочке два электрона имеют одинаково направленные спины, то есть способны образовывать связи с электронами другого атома. Валентность атома кислорода равна двум. При этом структура молекулы имеет вид:
\[O=O.\]Запишем электронную конфигурацию атома азота $(N)$:
\[1s^22s^22p^3.\]Соответственно:
\[m=-1,0,1.\]Внешняя оболочка имеет три электрона, спины которых параллельны. Валентность атома азота равна трем. Соответственно, структурная формула молекулы азота запишется как:
\[N\equiv N.\]Ответ: $H-H;$ $O=O;$ $N\equiv N.$
Задание: Каким будет основной терм и основные состояния у атома углерода?
Решение:
Запишем электронную конфигурацию атома углерода $(C)$:
\[1s^22s^22p^2\]Применим правило Хунда. На внешней оболочке имеются два электрона, следовательно, $S=1$, то есть основной терм будет триплетом. Выберем максимальное значение $L$ для двух эквивалентных $p$-электронов. Учтем принцип Паули. Запишем возможные квантовые числа, которые характеризуют состояния электронов.
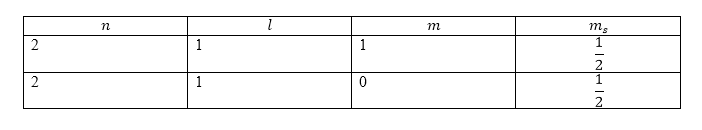
Рисунок 2.
Числа выбираются так, чтобы (для начала) получалось максимальное значение проекции орбитального момента. Так, ${\max \left(M_L\right)\ }=1$, значит $L={\max \left(M_L\right)\ }=1$. Основным термом является:
${}^3P,$ он имеет три состояния: ${}^3{P_{0,1,2}.}\ $Основным является состояние: ${}^3{P_{0.}.}$
Ответ: Основной терм - ${}^3P,\ $основное состояние - ${}^3{P_0.}$











