Запишем уравнение состояния идеального газа в виде:
Закон Авогадро и число Лошмидта
Пусть температура постоянна ($T=const$), давление не изменяется ($p=const$), объем постоянный $(V=const)$:
$N$ - число частиц (молекул) любого идеального газа величина неизменная. Это утверждение называется законом Авогадро. Или по-другому закон Авогадро звучит следующим образом:
один моль любого газа при фиксированных давлении и температуре занимают одинаковые объемы.
Очень часто при решении задач используется то, что при нормальных условиях (н.у.) (давлении в одну атмосферу или, что тоже самое $p={10}^5Па=760\ мм\ рт.ст,\ t=0^o C$) молярный объем любого идеального газа:
\[\frac{RT}{p}=V_{\mu }=22,4\cdot {10}^{-3}\frac{м^3}{моль}=22,4\frac{л}{моль}\ \left(3\right).\]Концентрацию молекул идеального газа при нормальных условиях:
\[n_L=\frac{N_A}{V_{\mu }}=2,686754\cdot {10}^{25}м^{-3}\ \left(4\right),\]называют числом Лошмидта.
Историческая справка
Амедео Авогадро установил свой закон в 1811 г., развивая атомно-молекулярную теорию. При этом он допускал, что молекула может состоять из нескольких атомов. Это дало ему возможность объяснить в терминах атомно-молекулярной теории опыты Гей-Люссака, который установил закон объемных отношений, но с точки зрения теории объяснить не смог и принял как опытный факт. Закон объемных отношений гласит: соотношение между объемами реагирующих газов выражается простыми целыми числами.
Как следствие из закона Авогадро отношение плотностей идеальных газов равно отношению их молярных масс при тех же условиях:
\[\frac{{\rho }_1}{{\rho }_2}=\frac{{\mu }_1}{{\mu }_2}\ (5)\]Отношение $\frac{{\rho }_1}{{\rho }_2}$ называют относительной плотностью первого газа по второму. Часто выражение (5) записывают через массы веществ (что при одинаковых объемах то же самое):
\[D=\frac{{\rho }_1}{{\rho }_2}=\frac{m_1}{m_2}\ \left(6\right).\]Относительную плотность чаще всего вычисляют по отношению к воздуху или водороду, используя, что молярные массы водорода и воздуха известны и равны, соответственно:
\[{\mu }_{H_2}=2\cdot {10}^{-3}\frac{кг}{моль}\] \[{\mu }_{vozd}=29\cdot {10}^{-3}\frac{кг}{моль}\]Закон Авогадро особенно широко используется в химии. Он позволяет устанавливать состав газовых соединений и находить их относительную атомную и молекулярную массу.
Задание: Определите, какой объем займут 0,5 моля ${Cl}_2$ при нормальных условиях. Какой объем займут 140 гр хлора при н.у.?
Решение:
Из закона Авогадро следует, что один моль любого газа при н.у. занимает $V_{\mu }=22,4\cdot {10}^{-3}\frac{м^3}{моль}$, воспользуемся этим.
\[V_{{Cl}_2}=\nu \cdot V_{\mu }\ \left(1.1\right).\]Так как единицы данных приведены в СИ, проведем вычисления:
\[V_{{Cl}_2}=0,5\cdot 22,4\cdot {10}^{-3}=11,2\cdot {10}^{-3}\ (м^3)\]Для решения второй части задачи используем формулу для количества вещества:
\[\nu =\frac{m}{\mu }\ (1.2)\]Молярную массу хлора найдем с помощью таблицы Менделеева:
\[{\mu }_{{Cl}_2}=70\cdot {10}^{-3}\frac{кг}{моль}\ \left(1.3\right).\]Используем формулу (1.1), подставим (1.2), получим:
\[V_{{Cl}_2}=\frac{m}{м}V_м\ \left(1.4\right).\]Проведем расчет, если m=140 гр = 140$\cdot {10}^{-3}\ кг$:
\[V_{{Cl}_2}=\frac{140\cdot {10}^{-3}}{70\cdot {10}^{-3}}\cdot 22,4\cdot {10}^{-3}=44,8\cdot {10}^{-3}\ (м^3)\]Ответ: Объем 0,5 молей хлора займут объем 11,2 л. Объем 140 гр хлора 44,8 л.
Задание: 13, 8 грамма вещества сгорают полностью. В результате горения получается 26,4 гр $CO_2$ и 16,2 гр $H_2O.$ Относительная плотность паров искомого газа по водороду равна 23. Какова молекулярная формула вещества?
Решение:
Найдем молярную массу искомого вещества по формуле, если известно, что ${\mu }_{H_2}$=2$\frac{г}{моль}$:
\[D=\frac{m_1}{m_2}=\frac{{\mu }_x}{{\mu }_{H_2}}\to {\mu }_x=23\cdot 2=46\ \left(\frac{г}{моль}\right)\ (2.1).\]Найдем массу углерода, составив пропорцию:
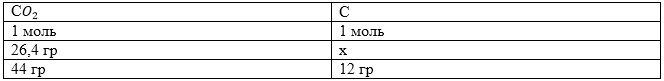
$m_C$=$x=\frac{26,4\cdot 12}{44}$=7,2 (гр.)
аналогично найдем массу водорода:
\[m_H=\frac{16,2\cdot 2}{18}=1,8\ (гр.)\]И для кислорода:
\[m_O=13,8-7,2-1,8=4,8\ \left(гр\right)\]согласно закону сохранения массы.
Найдем количество молей веществ:
\[{\nu }_C=\frac{7,2}{12}=0,6\ \left(моль\right)\] \[{\nu }_Н=\frac{1,8}{1}=1,8\ \left(моль\right)\] \[{\nu }_O=\frac{4,8}{16}=0,3\ \left(моль\right)\]Из закона отношений:
\[{\nu }_C:н_Н:н_O=0,6:1,8:0,3\ (2.2)\]Разделим числа из последнего соотношения на 0,3, получим:
2:6:1
Следовательно, простейшая формула: $C_2H_6O$.
\[{\mu }_{C_2H_6O}=24+6+16=46\ \left(\frac{г}{моль}\right)(2.3)\]Полученная молярная масса в формуле (2.1), также $46\ \left(\frac{г}{моль}\right)$, следовательно, простейшая и истинная формулы искомого вещества совпадают.
Ответ: Формула сгоревшего вещества $C_2H_6O.$











