Кинетическая энергия молекулы
В газе молекулы совершают свободное (изолированное от других молекул) движение, лишь время от времени сталкиваясь друг с другом или со стенками сосуда. До тех пор, пока молекула совершает свободное движение, у нее имеется только кинетическая энергия. Во время столкновения у молекул появляется и потенциальная энергия. Таким образом, полная энергия газа представляют сумму кинетической и потенциальной энергий ее молекул. Чем разреженное газ, тем больше молекул в каждый момент времени пребывает в состоянии свободного движения, имеющих только кинетическую энергию. Следовательно, при разрежении газа уменьшается доля потенциальной энергии в сравнении с кинетической.
Средняя кинетическая энергия молекулы пpи равновесии идеального газа обладает одной очень важной особенностью: в смеси различных газов средняя кинетическая энергия молекулы для различных компонентов смеси одна и та же.
Например, воздух представляет собой смесь газов. Средняя энергия молекулы воздуха для всех его компонентов пpи нормальных условиях, когда воздух еще можно рассматривать как идеальный газ, одинакова. Данное свойство идеальных газов может быть доказано на основании общих статистических соображений. Из него вытекает важное следствие: если два различных газа (в разных сосудах) находятся в тепловом равновесии друг с другом, то средние кинетические энергии их молекул одинаковы.
В газах обычно расстояние между молекулами и атомами значительно больше, чем размеры самих молекул, силы взаимодействия молекул не велики. Вследствие чего газ не имеет собственной формы и постоянного объема. Газ легко сжимается и может неограниченно расширяться. Молекулы газа движутся свободно (поступательно, могут вращаться), лишь иногда сталкиваясь с другими молекулами и стенками сосуда, в котором находится газ, причем движутся с очень большими скоростями.
Движение частиц в твердых телах
Строение твёрдых тел принципиально отлично от строения газов. В них межмолекулярные расстояния малы и потенциальная энергия молекул сравнима с кинетической. Атомы (или ионы, или целые молекулы) нельзя назвать неподвижными, они совершают беспорядочное колебательное движение около средних положений. Чем больше температура, тем больше энергия колебаний, а следовательно, и средняя амплитуда колебаний. Тепловыми колебаниями атомов объясняется и теплоемкость твёрдых тел. Рассмотрим подробнее движения частиц в кристаллических твердых телах. Весь кристалл в целом представляет собой очень сложную связанную колебательную систему. Отклонения атомов от средних положений невелики, и поэтому можно считать, что атомы подвергаются действию квазиупругих сил, подчиняющихся линейному закону Гука. Такие колебательные системы называются линейными.
Существует развитая математическая теория систем, подверженных линейным колебаниям. В ней доказана очень важная теорема, суть которой состоит в следующем. Если система совершает малые (линейные) взаимосвязанные колебания, то путем преобразования координат ее формально можно свести к системе независимых осцилляторов (у которых уравнения колебаний не зависят друг от друга). Система независимых осцилляторов ведет себя подобно идеальному газу в том смысле, что атомы последнего тоже можно рассматривать как независимые.
Именно используя представление о независимости атомов газа, мы приходим к закону Больцмана. Этот очень важный вывод представляет простую и надежную основу для всей теории твёрдого тела.
Число осцилляторов с заданными параметрами (координаты и скорости) определяется так же, как и число молекул газа в заданном состоянии, по формуле:
\[n_a=Ce^{-\frac{E_a}{kT}}\ (1),\]где
\[E_a=\frac{mv^2}{2}+\frac{kx^2}{2}(2)\]-- энергия осциллятора.
Закон Больцмана (1) в теории твёрдого тела не имеет ограничений, однако формула (2) для энергии осциллятора взята из классической механики. Пpи теоретическом рассмотрении твёрдых тел нужно опираться на квантовую механику, для которой характерна дискретность изменения энергии осциллятора. Дискретность энергии осциллятора становится несущественной только пpи достаточно высоких значениях его энергии. Это значит, что (2) можно пользоваться лишь пpи достаточно высоких температурах. Пpи высоких температурах твёрдого тела, близких к температуре плавления, из закона Больцмана вытекает закон равномерного распределения энергии по степеням свободы. Если в газах на каждую степень свободы в среднем приходится количество энергии, равное (1/2) kT, то у осциллятора одна степень свободы, кроме кинетической, имеет потенциальную энергию. Поэтому на одну степень свободы в твёрдом теле пpи достаточно высокой температуре приходится энергия, равная kT. Исходя из этого закона, нетрудно рассчитать полную внутреннюю энергию твердого тела, а вслед за ней и его теплоемкость. Моль твердого тела содержит NA атомов, а каждый атом имеет три степени свободы. Следовательно, в моле содержится 3 NA осцилляторов. Энергия моля твердого тела
\[E_{\mu }=3N_AkT=3RT(3)\]а молярная теплоемкость твердого тела пpи достаточно высоких температурах
\[c=\frac{dE_{\mu }}{dT}=3R\ (4)\]Это закон Дюлонга и Пти: все простые (одноатомные) твёрдые тела в области высоких температур имеют одну и ту же, не зависящую от температуры, молярную теплоемкость, равную 3R.
Опыт подтверждает этот закон.
Жидкости занимают промежуточное положение между газами и твердыми телами. Молекулы жидкости не расходятся на большие расстояния, и жидкость в обычных условиях сохраняет свой объем. Но в отличие от твердых тел молекулы не только совершают колебания, но и перескакивают с места на место, то есть совершают свободные движения. При повышении температуры жидкости кипят (существует так называемая температура кипения) и переходят в газ. При понижении температуры жидкости кристаллизуются и становятся твердыми веществами. Существует такая точка в поле температур, в которой граница между газом (насыщенным паром) жидкостью исчезает (критическая точка). Картина теплового движения молекул в жидкостях вблизи температуры затвердевания очень похожа на поведение молекул в твердых телах. К примеру, коэффициенты теплоемкости прочти совпадают. Так как теплоемкость вещества при плавлении изменяется слабо, то можно сделать вывод, что характер движения частиц в жидкости близок движению в твердом теле (при температуре плавления). При нагревании свойства жидкости постепенно изменяются, и она становится более похожа на газ. У жидкостей средняя кинетическая энергия частиц меньше потенциальной энергии их межмолекулярного взаимодействия. Энергия межмолекулярного взаимодействия в жидкости и твердых телах отличаются несущественно. Если сравнить теплоту плавления и теплоту испарения, то увидим, что при переходе из одного агрегатного состояния в другое теплота плавления существенно ниже, теплоты парообразования. Адекватное математическое описание структуры жидкости может быть дано лишь с помощью статистической физики. Например, если жидкость состоит из одинаковых сферических молекул, то ее структуру можно описать радиальной функцией распределения g(r), которая дает вероятность обнаружения какой-либо молекулы на расстоянии r от данной, выбранной в качестве точки отсчета. Экспериментально эту функцию можно найти, исследуя дифракцию рентгеновских лучей или нейтронов, можно провести компьютерное моделирование этой функции, используя механику Ньютона.
Кинетическая теория жидкости была разработана Я.И. Френкелем. В этой теории жидкость рассматривается, как и в случае твердого тела, как динамическая система гармонически осцилляторов. Но в отличие от твердого тела положение равновесия молекул в жидкости имеет временный характер. Поколебавшись около одного положения, молекула жидкости перескакивает в новое положение, расположенное по соседству. Такой перескок происходит с затратой энергии. Среднее время «оседлой жизни» молекулы жидкости можно рассчитать как:
\[\left\langle t\right\rangle =t_0e^{\frac{W}{kT}}\left(5\right),\]где $t_0\ $- период колебаний около одного положения равновесия. Энергия, которую должна получить молекула, чтобы из одного положения перейти в другое, называется энергией активации W, а время нахождения молекулы в положении равновесия -- временем «оседлой жизни» t.
У молекулы воды, например, при комнатной температуре, одна молекула совершает около 100 колебаний и перескакивает в новое положение. Силы притяжения между молекулам жидкости велики, чтобы сохранялся объем, но ограниченность оседлой жизни молекул ведет к возникновению такого явления, как текучесть. Во врем колебаний частицы около положения равновесия они непрерывно соударяются друг с другом, поэтому даже малое сжатие жидкости приводит к резкому «ожесточению» соударений частиц. Это означает резкое повышение давления жидкости на стенки сосуда, в котором ее сжимают.
Задание: Определить удельную теплоёмкость меди. Считать, что температура меди близка к температуре плавления. (Молярная масса меди $\mu =63\cdot 10^{-3}\frac{кг}{моль})$
Решение:
Согласно закону Дюлонга и Пти моль химически простых веществ при температурах, близких к температуре плавления, имеет теплоемкость:
\[c=\frac{dE_{\mu }}{dT}=3R\ \left(1.1\right)\]Удельная теплоемкость меди:
\[С=\frac{с}{\mu }\to С=\frac{3R}{\mu }\left(1.2\right),\] \[С=\frac{3\cdot 8,31}{63\cdot 10^{-3}}=0,39\ \cdot 10^3(\frac{Дж}{кгК})\]Ответ: Удельная теплоёмкость меди $0,39\ \cdot 10^3\left(\frac{Дж}{кгК}\right).$
Задание: Объясните упрощённо с точки зрения физики процесс растворения соли (NaCl) в воде.
Решение:
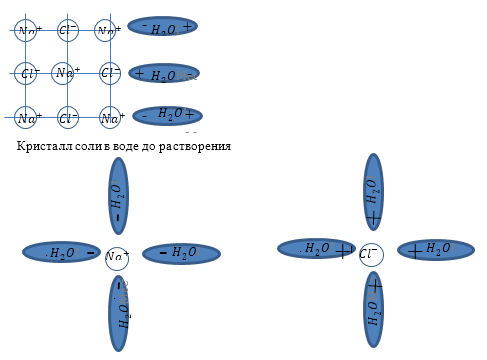
Рис. 1
Основу современной теории растворов создал Д.И. Менделеев. Он установил, что при растворении протекают одновременно два процесса: физический -- равномерное распределение частиц растворяемого вещества по всему объему раствора, и химический -- взаимодействие растворителя с растворяемым веществом. Нас интересует физический процесс. Молекулы соли не разрушают молекулы воды. В этом случае нельзя было бы выпарить воду. Если бы молекулы соли присоединялись бы к молекулам воды -- мы получали бы некое новое вещество. И внутрь молекул волы молекулы соли проникнуть не могут.
Между ионами Na+ и Cl-- хлора и полярными молекулами воды возникает ионно-дипольная связь. Она оказывается прочнее, чем ионные связи в молекулах поваренной соли. В результате этого процесса связь между ионами, расположенными на поверхности кристаллов NaCl, ослабляется, ионы натрия и хлора отрываются от кристалла, а молекулы воды образуют вокруг них так называемые гидратные оболочки. Отделившиеся гидратированные ионы под влиянием теплового движения равномерно распределяются между молекулами растворителя.













