Теория молекулярных орбиталей
Вариационный метод дает возможность приблизительно определить энергию системы, но для этого необходимо подобрать правильную волновую функцию, а это далеко не простая задача. Существуют два метода подбора волновой функции: по теории молекулярных орбиталей и по теории валентных связей. Эти две теории подходят к построению исходной волновой функции совершенно различными путями и отражают разные представления об основной модели строения молекулы.
Теория валентных связей была разработана на много лет раньше теории молекулярных орбиталей. Она дает более наглядное представление о строении молекулы, и поэтому ее чаще применяют для качественного решения некоторых вопросов. Однако в последние годы теория молекулярных орбиталей стала более популярной, что можно объяснить простотой этой теории и используемого в ней математического аппарата. В то время как теория валентных связей сохраняет за атомами, входящими в состав молекулы, их индивидуальность, теория молекулярных орбиталей рассматривает молекулу как единую частицу, используя основные представления о строении атома.
Как в атоме есть атомные орбитали, так и в молекуле есть молекулярные орбитали. Различие состоит в том, что молекулярные орбитали многоцентровые. Тем не менее, теория молекулярных орбиталей предлагает для электрона в молекуле волновую функцию, подобную волновой функции электрона в атоме. По этой теории вероятность нахождения электрона в определенной части объема будет пропорциональна , и так же, как в атоме, каждая молекулярная орбиталь будет зависеть от ряда квантовых чисел, которые определяют ее энергию и пространственное расположение. Допускается, что принцип заполнения орбиталей в молекуле такой же, как в атоме, т. е. на каждой молекулярнойї орбитали могут располагаться два электрона с противоположными спинами, и, начиная с орбиталей самого низкого уровня энергии, электроны один за другим заполняют следующие орбитали.
Связывающие и разрыхляющие орбитали
Исходное энергетическое состояние в атомах вырождено, но при соединении атомов в молекулу оно расщепляется на два новых энергетических состояния: одно с более низкой, а другое с более высокой энергией, чем исходное атомное состояние. Схематично это показано на рис. 1.
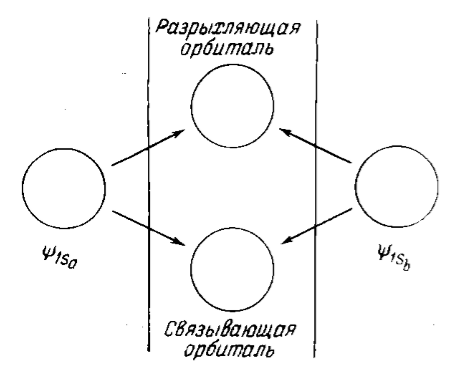
Рисунок 1. Комбинации двух атомных орбиталей с образованием двух молекулярных орбиталей
По терминологии теории молекулярных орбиталей, орбиталь, которой соответствует меньшая энергия, называется связывающей, орбиталь с большей энергией называется разрыхляющей.
Для любого расстояния между ядрами можно вычислить общую энергию молекулы; полученная зависимость носит название кривой потенциальной энергии молекулы (рис. 2). На кривой имеется минимум («яма»), соответствующий стабильному состоянию молекулы с межъядерным расстоянием Rравн, которое носит название равновесной длины связи (или просто длины связи; например, в рассматриваемом выше ионе $Н_2^+ \cdot Rравн=1.06 Å$).
Орбиталь является связывающей или разрыхляющей молекулярной орбиталью в соответствии с определениями:
-
Молекулярная орбиталь называется связывающей, если заселение ее электронами приводит к понижению общей энергии молекулы.
-
Молекулярная орбиталь называется антисвязывающей (разрыхляющей), если заселение ее электронами приводит к повышению общей энергии молекулы.
Зависимость энергии орбитали от межъядерного расстояния приведена на рис. 2.
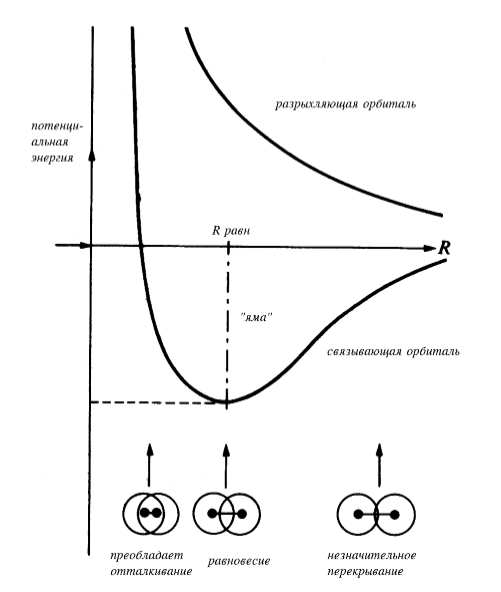
Рисунок 2. Кривые потенциальной энергии иона $Н_2^+$.
Образование разрыхляющей орбитали показано на рисунке 3.
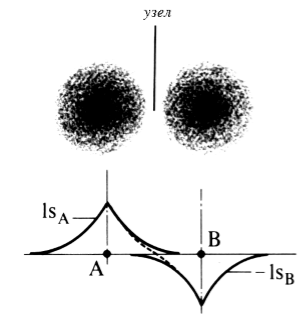
Рисунок 3. Образование антисвязывающей (разрыхляющей) молекулярной орбитали
Заполнение орбиталей электронами
На обеих орбиталях может поместиться по два электрона, но в первую очередь будет заполняться связывающая орбиталь, так как ей соответствует меньшая энергия. Поэтому в молекулярном ионе водорода электрон находится на связывающей орбитали. В более сложных системах заполнение разрыхляющих орбиталей очень важно для определения характера связи.
При рассмотрении молекулы методом $МО$ электроны размещают по орбиталям, охватывающим всю молекулу, т. е. по молекулярным орбиталям. Обычно получают приближенную форму и энергии этих $MO$, составляя подходящие линейные комбинации атомных орбиталей (метод $MO$ $ЛКАО$). Так, для молекулы $Н_2$ две молекулярные орбитали можно построить из $1s$-орбиталей атома водорода (рис. 4).
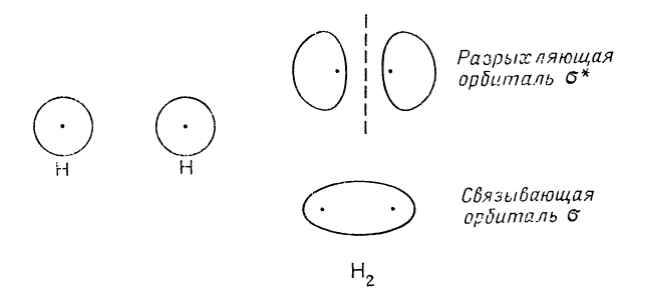
Рисунок 4. Связывающая и разрыхляющая орбитали для молекулы водорода
Эти две орбитали обозначаются как связывающая орбиталь $δ$ и разрыхляющая орбиталь $δ*$. Поскольку электронная плотность у $δ*$-орбитали сосредоточена главным образом у двух ядер, а не между ними, возникает стремление расталкивания ядер, т. е. разрыхления. В молекуле $Н_2$ разрыхляющая орбиталь не заселена, поэтому образуется стабильная молекула.












