Приближение поля Хартри
Для многоэлектронного атома волновая функция системы имеет вид:
где ${\xi }_{i\ }(i=1,2,\dots Z)$ -- координаты всех электронов в атоме. Так как электроны взаимодействуют, то использовать одноэлектронные волновые функции в данном случае не возможно. Значит, чтобы описать стационарные состояния атома, имеющего $Z$ электронов, cследует решать уравнение Шредингера в $3Z$ --мерном пространстве. Подобная задача решается приближенно.
Чаще всего для исследования многоэлектронного атома используют приближение самосогласованного поля Хартри. При этом состояние каждого электрона описывают своей волновой функцией ${\psi_i(\xi}_{i\ })$. Данная функция находится из уравнения Шредингера для одного $i$-го электрона в самосогласованном потенциале, который создается ядром и всей оставшейся суммой электронов, за исключением $i$-го. При этом имеет значение то, что самосогласованный потенциал сохраняет центральную симметрию, значит, возможно, выделение угловой части одноэлектронной функции и охарактеризовать координатную волновую функцию с помощью квантовых чисел $n,l,m$ . Спиновое состояние электрона определяют квантовым числом $m_s$. Так в приближении самосогласованного поля появляется такой же набор квантовых чисел, который используют для характеристики атома с одним электроном.
Рассмотрим атом с двумя электронами (например, атом гелия). При этом состояние одного электрона опишем функцией $\psi_1({\xi }_1)$, второго - $\psi_2({\xi }_2)$. Каждый данный электрон создает электростатический потенциал:
где ${\rho }_i\left({\overrightarrow{r}}_i\right)=q_e{\left|\psi_i({\overrightarrow{r}}_i)\right|}^2$- плотность заряда, которую создает каждый электрон в пространстве. Самосогласованный потенциал, в котором движется каждый электрон можно представить как:
Уравнения самосогласованного поля запишем как:
Уравнения Хартри (4) и (5) не удовлетворяют принципу тождественности. Полная волновая функция двух электронов не будет ни симметричной, ни антисимметричной по отношению к перестановкам электронов ($\psi\left({\overrightarrow{r}}_1,{\overrightarrow{r}}_2\right)=\psi_1\left({\overrightarrow{r}}_1\right)\psi_2\left({\overrightarrow{r}}_2\right)\ $). Уравнения самосогласованного поля Хартли были преобразованы В.А. Фоком для того, чтобы они удовлетворяли принципу тождественности. Эффективность использования метода Хартли - Фока для описания структуры атома со многими электронами вызвана тем, что основной частью самосогласованного потенциала становится потенциал, который определяет взаимодействие с ядром атома, при этом энергия взаимодействия между электронами является существенно меньшей. Этот факт позволяет упростить задачу и рассмотреть структуру многоэлектронного атома в рамках теории возмущений. При этом использовать как нулевое приближение систему невзаимодействующих электронов.
Общие принципы описания многоэлектронного атома
Определим, чем руководствуются при построении качественной картины структуры атома с произвольным числом электронов.
-
Заполнения оболочек атомов электронами происходит в соответствии с правилом Маделунга, которое утверждает:
-
из двух подоболочек ниже по энергии располагается та, у которой сумма $n+l$ является наименьшей;
-
если для двух подоболочек величина сумм $n+l$ совпали, то ниже (по энергии) находится подоболочка с меньшим значением главного квантового числа.
Справедливость данного правила подтверждает периодический закон Д.И. Менделеева.
-
-
В каждой электронной конфигурации многоэлектронных атомов можно построить определенное число термов, которые определяет величина полного орбитального момента ($\overrightarrow{L}$):
\[\overrightarrow{L}=\sum\limits_i{{\overrightarrow{l}}_i}\left(6\right),\]и полного спинового момента ($\overrightarrow{S}$):
\[\overrightarrow{S}=\sum\limits_i{{\overrightarrow{s}}_i}\left(7\right)\]всех электронов атома. Если взаимодействия электронов в атоме нет, то все термы являются вырожденными. Учет взаимодействия ведет к снятию вырождения. При этом величина расщепления определена пространственной структурой волновой функции терма и связана с мультиплетностью терма.
-
Спин -- орбитальное взаимодействие в атоме ведет к возникновению тонко структуры терма. При этом количество компонентов мультиплета определено числом возможных типов ориентации векторов $\overrightarrow{L}\ и\ \overrightarrow{S}$ в пространстве (числом возможных значений числа J, которое задает величину механического момента всей электронной оболочки атома). Обозначают состояние атома с многими электронами как:
\[{}^{2S+1}{L_J\left(8\right).}\]При этом число состояний в терме равно:
\[min\left\{\left(2S+1\right),\left(2L+1\right)\right\}\left(9\right).\]При $L\ge S$ число компонент в терме $2S+1$. Если $L\le S$, количество компонент в терме равно: $2L+1.$ Синглетные термы всегда имеют единственную компоненту, для них терм и состояние совпадают.
-
Правило интервалов Ланде. Расстояние между соседними компонентами мультиплета определено как:
\[\delta E_J=E_J-E_{J-1}=AJ\left(10\right),\]если $A >0$, то мультиплет называют нормальным, при $A
-
Приближения $LS$ и $jj$ связей. Если учитывать только электростатическое взаимодействие электронов и не учитывать спин -- орбитальное взаимодействие (при этом вводят термы в которых величины квадратов орбитального и спинового моментов суммы электронов в атоме определяются точно), то такая схема построения термов называется $LS$ -- приближением. Данная схема реализуется не всегда. В приближении $LS$ связи понятия: конфигурация электронов -- терм -- состояние отражает иерархию взаимодействий в атоме: взаимодействие электронов с ядром -- электростатическое взаимодействие электронов -- спин-орбитальное взаимодействие.
В случае, если энергия спин --орбитального взаимодействия много больше, чем энергия электростатического взаимодействия электронов ($E_{LS}\gg E_{ee}$), то электростатическим взаимодействием электронов в атоме можно пренебречь. В таком случае состояние каждого электрона определяют квантовыми числами $(j, m_j)$. Если известны значения $j$ для всех электронов атома в известной конфигурации $(j=1,...N)$, то считают, что известен терм атома в приближении $jj$ --связи. Такой терм обозначают как:
\[\left\{j_1,\dots ,j_N\right\}.\]Если в дальнейшем учитывают электростатическое взаимодействие электронов, то терм расщепляется на группу состояний, количество которых определено числом значений $J$ (возможные значения полного механического момента атомарной электронной оболочки):
\[\overrightarrow{J}=\sum\limits_i{{\overrightarrow{j}}_i\left(11\right).}\]При $jj$ -- взаимодействии последовательность интенсивности взаимодействия следующая: взаимодействие электронов и ядра -- спин -- орбитальное взаимодействие -- электростатическое взаимодействие.
-
Правила Хунда (используются для построения основного терма):
-
ниже по энергии расположен терм, мультиплетность которого максимальна;
-
если мультиплетности равны, то минимальна энергия у терма, которому принадлежит максимальная величина суммы орбитального момента.
-
Задание: Конфигурация гелиеподобного иона задана как: $1snp$. Запишите соответствующие термы и состояния в приближении $LS$ -- связи.
Решение:
В приближении $LS$ -- связи для заданной конфигурации имеем следующие термы:
\[{}^1{P,}{}^3{P(1.1)}\]Состояния, которые соответствуют этим термам:
\[{}^1{P_1,\ }{}^3{P_{0,1,2}\left(1.2\right).}\]Ответ: Имеется два терма, четыре состояния. Триплетный терм имеет три состояния, для синглета терм и состояние совпадают.
Задание: Каковы основные термы и основные состояния у атомов: бора и углерода?
Решение:
-
Атом Бора имеет конфигурацию $1s_22s_22p$. Во внешней оболочке атома Бора присутствует один $p$ --электрон/ Следовательно, терм запишем как:
\[{}^2P(2.1)\]Терм будет иметь два состояния:
\[{}^2{P_{\frac{1}{2}},\ }{}^2{P_{\frac{3}{2}}\ }\left(2.2\right).\]Так как подоболочка имеет заполнение менее 50\%, значит мультиплет нормальный, следовательно, основное состояние:
\[{}^2{P_{\frac{1}{2}}.}\] -
Атом углерода имеет конфигурацию: $1s_22s_22p_{2.}$Используем правило Хунда. На внешней оболочке два электрона, следовательно, $S=1$, то есть основной терм является триплетом. Выберем максимальное значение $L$ для двух эквивалентных $p$-электронов. Учтем принцип Паули. Запишем возможные квантовые числа, которые характеризуют состояния электронов.
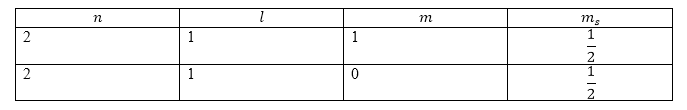
Рисунок 1.Числа выбираются так, чтобы (для начала) получалось максимальное значение проекции орбитального момента. Так, ${\max \left(M_L\right)\ }=1$, значит $L={\max \left(M_L\right)\ }=1$. Основным термом является:
${}^3P,$ он имеет три состояния: ${}^3{P_{0,1,2}.}\ $Основным является состояние: ${}^3{P_{0.}.}$
Ответ: 1) Основной терм - ${}^2P,\ $основное состояние - ${}^2{P_{\frac{1}{2}}.}$ 2) Основной терм - ${}^3P,\ $основное состояние - ${}^3{P_0.}$












