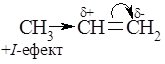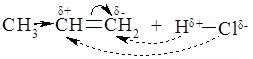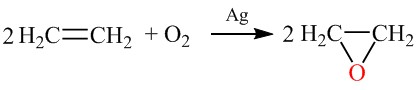Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны. Алкены легко вступают в реакции окисления, присоединения а также способны к алильному радикальному замещению.
Реакции присоединения
-
Гидрирование Присоединение водорода (реакция гидрирования) к алкенам проводят в присутствии катализаторов. Чаще всего используют измельченные металлы - платину, никель, палладий и др. В результате образуются соответствующие алканы (насыщенные углеводороды).
$CH_2=CH_2 + H2 → CH_3–CH_3$
-
Присоединение галогенов. Алкены легко при обычных условиях вступают в реакции с хлором и бромом с образованием соответствующих дигалогеналканов, в которых атомы галогена находятся у соседних атомов углерода.
Замечание 1При взаимодействии алкенов с бромом наблюдается обесцвечивание желто-бурой окраски брома. Это одна из старейших и самых простых качественных реакций на ненасыщенные углеводороды, поскольку аналогично реагируют также алкины и алкадиены.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
-
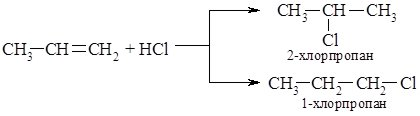
Присоединение галогеноводородов. При взаимодействии этиленовых углеводородов с галогеноводородами ($HCl$, $HBr$) образуются галогеналканы, направление реакции зависит от строения алкенов.
В случае этилена или симметричных алкенов реакция присоединения происходит однозначно и ведет к образованию только одного продукта:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
В случае несимметричных алкенов возможно образование двух разных продукта реакции присоединения:
Замечание 2На самом деле в основном образуется только один продукт реакции. Закономерность направлении прохождения таких реакций установил российский химик В.В. Марковников в 1869 Она носит название правило Марковникова. При взаимодействии галогеноводородов с несимметричными алкенами атом водорода присоединяется по месту разрыва двойной связи в наиболее гидрированного атома углерода, то есть до того, что соединен с большим количеством атомов водорода.
Данное правило Марковников сформулировал на основе экспериментальных данных и только значительно позже оно получило теоретическое обоснование. Рассмотрим реакцию пропилена с хлористым водородом.
Одной из особенностей $p$-связи является его способность легко поляризоваться. Под влиянием метильной группы (положительный индуктивный эффект + $I$) в молекуле пропена электронная плотность $p$-связи смещается к одному из атомов углерода (= $CH_2$). Вследствие этого на нем возникает частичный отрицательный заряд ($\delta -$). На другом атоме углерода двойной связи в соответствии возникает частичный положительный заряд ($\delta +$).
Такое распределение электронной плотности в молекуле пропилена определяет место будущей атаки протоном. Это - атом углерода метиленовой группы (= $CH_2$), который несет частичный отрицательный заряд $\delta-$. А хлор, соответственно, атакует атом углерода с частичным положительным зарядом $\delta+$.
Как следствие, основным продуктом реакции пропилена с хлористым водородом является 2-хлорпропан.
-
Гидратация
Гидратация алкенов происходит в присутствии минеральных кислот и подчиняется правилу Марковникова. Продуктами реакции являются спирты
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
-
Алкилирование
Присоединение алканов к алкенам в присутствии кислотного катализатора ($HF$ или $H_2SO_4$) при низких температурах приводит к образованию углеводородов с большей молекулярной массой и часто используется в промышленности для получения моторного топлива
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Реакции окисления
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета:
-
Окисление перманганатом калия $KM_nO_4$ (реакция Е. Вагнера)
При окисления алкенов слабым раствором $KM_nO_4$ в слабощелочной среде образуются гликоли
$3CH_2=CH_2 + 2KM_nO_4 + 4H_2O → 3HO–CH_2–CH_2–OH + 2KOH + 2M_nO_2$
Данная реакция имеет стереоселективный характер, так как обусловлена образованием на промежуточных стадиях сложных цикличних эфиров.
-
Окисление пероксидом водорода в присутствии осмий (VIII) оксида
Продуктом данной реакции аналогично реакции Вагнера будет гликоль
$ CH_2=CH_2 + HO–OH → HO–CH_2–CH_2–OH$
-
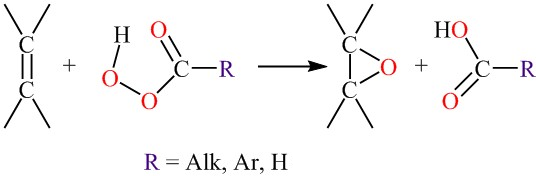
Окисление органическими пероксидами (реакция М. Прилежаева)
Определение 1Реакция М. Прилежаева - это синтез окиси этилена окислением олефинов гидропероксидами кислот, или надкислотами такими как надмуравьиная $HCOOH$, надбензойная $C_6H_5COOH$ и тому подобные.
Реакцию проводят смешиванием реагентов растворенных в инертном растворителе (гексан, бензол, хлороформ и др.) При температуре от -10 ° C до 60 ° C.
-
Окисление молекулярным кислородом
При окислении алкенов кислородом без катализатора происходит разрыв $\beta$-связи $C-H$ с образованием гидропероксидов, которые раскладываются на спирты и альдегиды. Если использовать катализатор $Ag$, то продуктами реакции будут окись этилена (органические оксиды)
-
Озонолиз
Замечание 3Реакция алкенов с озоном является наиболее важным методом окислительного расщепления алкенов по двойной связи. Ее используют для определения строения алкена. Данная реакция идет селективно по двойной связи с образованием пероксида водорода, альдегидов или кетонов.
В условиях реакции образованные альдегиды способны окисляться до соответствующих карбоновых кислот.
-
Окисление в присутствии солей палладия
Во время окисления алкенов в присутствии солей палладия $Pd$ (II) и воды образуются карбонильные соединения (альдегиды или кетоны). Например, этилен окисляется до этаналя. Данная реакция протекает в кислой среде и является промышленным способом добывания ацетальдегида
$2CH_2=CH_2 + O_2 → 2CH_3COH$
Реакции полимеризации
Молекулы алкенов способны присоединяться при определенных условиях друг к другу с раскрытием $\pi$-связей и образования димеров, триммеров или высокомолекулярных соединений - полимеров. Полимеризация алкенов может протекать как по свободнорадикальному, так и катионно-анионому механизму. Как инициаторы полимеризации применяют кислоты, перекиси, металлы и др. Реакцию полимеризации осуществляют также под действием температуры, облучения, давления. Типичным примером является полимеризация этилена с образованием полиэтилена
$nCH_2=CH_2 → (–CH_2–CH_{2^–})_n$
Реакции замещения
Реакции замещения для алкенов не являются характерными. Однако при высоких температурах (свыше 400 ° C) реакции радикального присоединения, что носят обратимый характер, и подавляются. В этом случае становится возможным провести замещение атома водорода, находящегося в аллильном положении при сохранении двойной связи
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$