Типичной свойством алканов является способность к радикальным реакциям. Это обстоятельство значительно ограничивает возможности прямого введения в молекулу различных функциональных групп.
Однако ни классические, ни современные механизмы карбон-ионных реакций превращения углеводородов не позволяют прогнозировать или хотя бы объяснить распределение продуктов конверсии во всей его реальной полноте.
Наиболее характерными для алканов химическими реакциями являются реакцции под действием различных радикальных агентов.
Но при определенных условиях могжет проходить реакция и с электронодефицитным, т.е. электрофильным реагентом, например, с протоном, карбокатионом, содержащим трехвалентный углерод (простейший пример -- ион $CH_{3^+}$), ионом нитрония ($NO_{2^+}$) и т.п. В такой реакции затрагиваются не только C--H-связи алканов, как в радикальных процессах, но и C--C связи. Реакция алканов с протоном наблюдается в суперкислых средах например в среде фторсульфоновой кислоты FSO3H или в среде безводной фтористоводородной кислоты в смеси с кислотами Льюиса. В результате равновесной реакции возникает комплексная кислота (в правой части приведенных ниже уравнений), обладающая огромной протонирующей способностью:
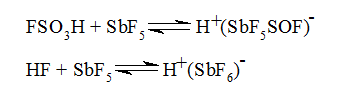
Рисунок 1.
Такая кислота способна протонировать даже алканы. Для улучшения растворимостей алканов в таких суперкислотах их применяют смеси с жидкими дополнительными реагентами - двуокисью серы $SO_2$ или $SO_2ClF$, Выбор такого растворителя диктуется очень жестким условием: растворитель должен обладать как можно более низкой основностью, чтобы не снижать суперкислотность среды. В такой среде алканы способны присоединять протон, образуя при этом ионы алкония, например:
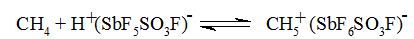
Рисунок 2.
Органические основания
Существуют основания, способные присоединять протоны или другие кислоты Льюиса по неподеленным электроотрицательным элементам. Поскольку орбитали, несущие неподеленные пары, принято обозначать как n-орбитали, такие основания получили название «$n$-основания» или «n-доноры электронов». У алканов имеются электроны лишь на $\sigma $-связи, поэтому алкан следует считать «$\sigma $-основанием» или «$\sigma $-донором». Существует также и иной вид основности, характерный для алкенов, их можно считать $\pi $-основами или $\pi $-донорами. Таким образом, доноры электронов можно классифицировать, как показано в табл. 1.
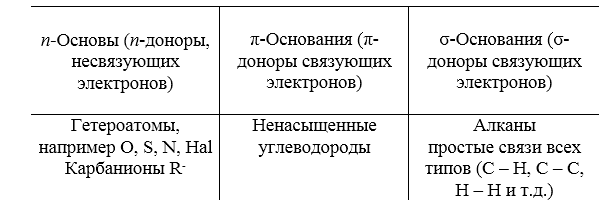
Рисунок 3. Типы доноров электронов. Автор24 — интернет-биржа студенческих работ
Как правило, основность убывает в ряде:
$n$-основания > \pi -основания > \sigma-основания$
Такая закономерность связана с рядом причин. Во-первых, $n$-орбитали (неподеленные пары) пространственно более доступны для взаимодействия с пустой орбиталью кислоты, чем $\pi $- и особенно $\sigma $-орбитали. Во-вторых, $n$-орбитали лежат выше $\pi $-орбиталей, и особенно $\sigma $-орбиталей, и поэтому возмущение, приводящее к образованию ковалентной связи при кислотно-основном взаимодействии, должно быть больше для $n$-орбиталей:
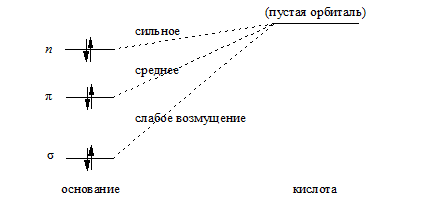
Рисунок 4.
Отсюда следует, что алканы должны быть самыми слабыми из нейтральных органических оснований.
Суперкислоты
Суперкислоты - вещества или смеси веществ, параметр кислотности которых превышает кислотность 100\% серной кислоты. В этом случае параметр кислотности принимается как способность кислоты протонировать произвольную основу и фактически совпадает с функцией кислотности Гаммета.
Итак суперкислоты имеют значение PKa с отрицательным знаком. Для разделения их силы используют функцию кислотности Гаммета -$H_0$
Для серной кислоты параметр кислотности составляет $H_0-12,2$. Простые суперкислоты к которым относятся, например, трифторметансульфоновая ($CF_3SO_3H$) и фторсульфоновая ($FSO_3H$) кислоты примерно в тысячу раз сильнее серной. Еще более сильной является фторостибатная кислота, образующаяся из пентафторида сурьмы ($SbF_5$) и безводного фтороводорода $HF$. При комбинировании $HSO_3F$ с $SbF_5$ фактор кислотности увеличивается в 103 раза. Эта смесь реагирует даже с алканами.
Суперкислоты является не отдельными составами, а собственно системой соединений, которые совмещаются для достижения высокой кислотности. В водных растворах однако нельзя доказать что кислота является суперкислотой, поскольку степень диссоциации не может быть больше 100\%. Это нивелирующий эффект воды.
Использование суперкислот для протонирования алканов
Термин «суперкислота» был изначально придуман Джеймсом Брайантом Конантом в 1927 году для описания кислот, которые были сильнее, чем обычные минеральные кислоты. Позже Джордж А. Олах подготовил так называемую «волшебную» кислоту, так названую в честь ее способности атаковать углеводороды, путем смешивания $FSO_3H$ и фторсульфоновой кислоты ($FSO_3H$). Название было придумано после того, как ученый смог растворить свечу в образце этой смеси. Это показывет способность суперкислот протонировать углеводороды, которые при нормальных кислых условиях не протонируются в какой-либо степени.
При 140 ${}^\circ$C (284 ${}^\circ$F), смесь $FSO_3H$-$FSO_3H$ протонируют метан с получением трет-бутилового карбокатиона, реакция, которая начинается с протонирования метана:
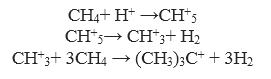
Рисунок 5.
Общие использование суперкислот включает предоставление среды для создания, сохранения, и описания карбкатионов. Карбокатионы являются промежуточными продуктами в многочисленных широкоприменяемых процессов, таких как производство пластмасс и производство высокооктановых бензинов.
В 1994 году Джордж Ола был удостоен Нобелевской премии за свое исследование суперкислот и их применение для прямого получения и наблюдения карбокатионов.
В нефтехимии, суперкислотные среды используются в качестве катализаторов, в особенности для алкилирования. Типичные катализаторы используемые в этой области - сульфатированные оксиды титана и циркония или специально обработанныеглинозем или цеолиты. Твердые кислоты используют для алкилирования бензола с этиленом и пропиленом, а также в процессе сложного ацилирования, хлорбензола.












