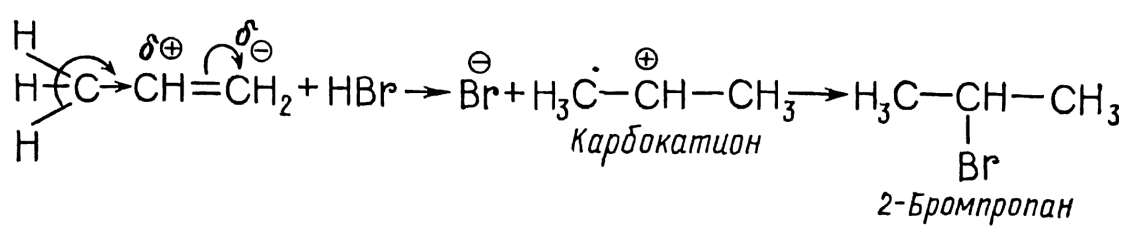Значительный интерес для синтеза галогеноалканов и изучения механизма реакции присоединения представляет взаимодействие алкенов с галогеноводородами. В отличие от симметричных электрофилов, галогеноводороды представляют собой несимметричные электрофильные реагенты. Присоединение любого несимметричного электрофила к несимметричному алкену, в принципе, могло бы дать смесь альтернативных продуктов, однако на практике обычно образуется лишь один из них. При гидрогалогенировании этилена и его гомологов, содержащих одинаковые заместители у атомов углерода, связанных двойной связью, получается лишь один продукт присоединения:
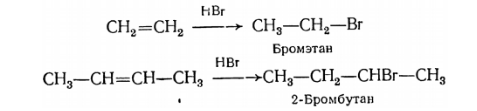
Присоединение галогеноводородных кислот к алкенам несимметричного строения могло бы приводить к двум различным продуктам. Однако реакция протекает преимущественно в одном направлении и так, что галоген присоединяется к менее, а водород к более богатому водородом углероду при двойной связи. Другими словами сформулированное в 1870 г. В. В. Марковниковым эмпирическое правило гласит, что несимметричные алкены присоединяют $HX$ таким путем, что преимущественно образуется продукт, в котором $H$ присоединяется к наименее замещенному, а $X$ – к наиболее замещенному концу двойной связи.
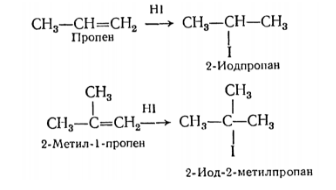
Эта закономерность была обнаружена Владимиром Васильевичем Марковниковым (1838—1904 гг., ученик А. М. Бутлерова) и носит название правила Марковникова.
Объяснение правила Марковникова
Механизм реакции следующий: в несимметричных алкенах, например пропилене, двойная $C = C$ -связь частично поляризована. Повышенная электронная плотность возникает у атома углерода, удаленного от метильной группы, а пониженная — у углерода, связанного с ней. Рассматриваемое явление обусловлено некоторой поляризацией связей $H—C$ в метильной группе вследствие большей электроотрицательности углерода (соответственно 2,5 и 2,1 в условных единицах). Это приводит к смещению электронных плотностей от группы $CH_3$ к двойной связи. Подобное смещение электронной плотности может быть обозначено прямой стрелкой, направленной от метильной группы к атому углерода и двойной связи, или изогнутой стрелкой, охватывающей три $H—C$-связи. Этот эффект можно объяснить и большей электроотрицательно- стью атома углерода при двойной связи, находящегося в состоянии $sp2$-гибридизации (2,62), чем электроотрицательность $sp3$-гибридизованного углерода метильной группы (2,5). Отсюда следует, что метильная группа является слабым электронодонорным заместителем. Сказанное подтверждается дипольным моментом пропилена (0,35D).
Обычно правило Марковникова объясняют различием в стабильности двух альтернативных карбокатионов. Например, в приведенном выше примере нормальный пропильный катион значительно менее стабилен, чем изопропильный катион, и поэтому реакция идет по второму пути. В действительности мы, конечно, должны рассматривать относительную стабильность альтернативных переходных состояний стадии образования возможных продуктов. Однако, согласно постулату Хэммонда, распределение заряды в переходном состоянии не сильно отличается от распределения заряда в карбокатионе и поэтому объяснение правила Марковникова через относительную стабильность карбокатионов вполне приемлемо.
Применение расчетных квантовомеханических методов показало, что в пропилене на крайнем атоме углерода при двойной связи содержится повышенная электронная плотность, а на атомах $C_2$ и $C_3$ она понижена (в единицах заряда электрона):
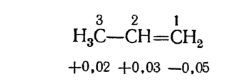
В ходе реакции гидрогалогенирования протон атакует атом уг-лерода с повышенной электронной плотностью. Образуется карбо- катион, который стабилизируется присоединением аниона галогена в 2-галогенопропан. Следовательно, реакция гидрогалогенирования протекает по механизму электрофильного присоединения:
Допустим обратный порядок присоединения галогеноводорода, при котором промежуточным продуктом явится карбокатион с положительным зарядом на крайнем атоме углерода:
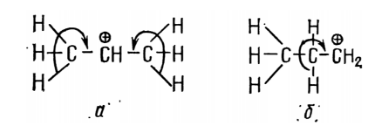
Таким образом, задача сводится к сравнению устойчивости обоих карбокатионов:
- с положительным зарядом на центральном томе углерода (а);
- положительным зарядом на крайнем метиленовом углероде (б).
Две метальные группы вследствие электронодонорности будут компенсировать положительный заряд на вторичном атоме углерода в большей степени, чем одна метиленовая группа на первичном атоме углерода. Следовательно, положительный заряд в катионе а делокализован в большей степени, он обладает меньшим запасом свободной энергии и устойчивее катиона б. Поэтому протон атакует крайний атом углерода пропилена. Очевидно, что третичный карбокатион в ряду:
$(R)_3C > (R)_2CH > RCH_2 > CH_3$
Значимость правила Марковникова
Сформулированные Марковниковым правила имеют и в настоящее время огромное значение для химиков-органиков. За 80—90 лет они подвергались неоднократной проверке. Было выяснено, при каких именно условиях они справедливы. Так, например, установлено, что присоединение бромистоводородной кислоты к несимметричным углеводородам идет против правила Марковникова, когда реакция протекает по радикальному механизму. В целом возражения вызвало, пожалуй, только правило, согласно которому хлор в хлоропроизводных облегчает дальнейшее замещение при том же атоме углерода. В действительности, например, оказалось, что при хлорировании монохлоридов в газовой фазе на свету второй атом хлора вступает чаще всего не к этому атому углерода, а к соседнему или даже еще более отдаленному.
В настоящее время электронные теории органической химии позволяют уже до известной степени объяснить внутренний механизм этих реакций, иными словами, механизм взаимного влияния атомов в реагирующих молекулах, и, таким образом, осуществляется та задача, решение которой было завещено Марковниковым будущим химикам.